Стратегии мониторинга и замены APT
Для рационального использования APT очень важно своевременно выявлять неэффективность лечения и менять схему терапии. Стратегии мониторинга и замены APT, с одной стороны, должны сократить риск развития лекарственной устойчивости, предупредить снижение эффективности препаратов второго ряда, а также иммунологическое и клиническое прогрессирование инфекции, а с другой — избежать необоснованного и преждевременного перехода на схемы второго ряда, учитывая при этом такие обстоятельства, как доступность средств мониторинга, риски и польза от альтернативных схем, а также текущую и будущую доступность препаратов. Можно выделить три основных подхода.
Таблица 1. Диагностические характеристики клинико-иллллунологических критериев вирусологической неудачи лечения, принятых ВОЗ.

Клинико-иммунологический мониторинг
В табл. 1 приведены характеристики текущих клиникоиммунологических критериев вирусологической неэффективности APT, принятых ВОЗ. Хотя эти данные нельзя назвать исчерпывающими, они показывают, что такие критерии выявляют примерно 25% пациентов с вирусологической неудачей и что у большинства пациентов, у которых обнаруживаются эти критерии, вирусологической неудачи на самом деле нет. По данным ряда исследований, прирост числа лимфоцитов CD4 < 50/мкл за 6 мес. является более ранним показателем вирусологической неудачи лечения, чем принятые сегодня критерии, однако он недостаточно точен из-за расхождений иммунологического и вирусологического ответов на начало APT. Одно исследование показало, что снижение числа лимфоцитов CD4 более чем на 30 % в периоде 12-го по 24-й месяцлечения имело более высокую прогностическую значимость положительного результата (54 %), но такую же чувствительность,90 а поперечные исследования выявили некоторое повышение чувствительности, но прогностическая значимость положительного результата была ниже 25 %.
Выборочное измерение вирусной нагрузки
Вирусную нагрузку можно определять не у всех пациентов, а выборочно — утех, у кого повышен риск вирусологической неудачи лечения. Судить о таком риске можно по клинико-иммунологическим критериям с высокой чувствительностью и низкой специфичностью. Например, критерием вирусологической неудачи лечения, обладающим чувствительностью 70—80%, является снижение числа лимфоцитов CD4, повышение этого числа менее чем на 10—20% за 6—12 мес. или сохранение на уровне 150—200/мкл в течение такого же времени. Кроме того, измерять вирусную нагрузку можно у пациентов, отобранных по клиникоиммунологическим алгоритмам, чтобы предотвратить ненужную замену схемы терапии и сократить число анализов. Проспективных исследований выборочного измерения вирусной нагрузки пока не опубликовано.
Обязательное измерение вирусной нагрузки
Результаты исследований в странах с высоким доходом показывают, что частое измерение вирусной нагрузки улучшает вирусологические исходы лечения, поэтому в этих странах определение вирусной нагрузки каждые 3—4 мес. уже давно является обязательной частью ведения всех больных. Однако данные, полученные в африканских когортных исследованиях, не подтвердили того факта, что доступность измерения вирусной нагрузки снижала смертность больных, начинавших APT. Согласно недавно опубликованной математической модели, польза от дополнительного определения числа лимфоцитов CD4 и вирусной нагрузки по сравнению с одним клиническим мониторингом невелика. Рандомизированное исследование различных стратегий мониторинга в Уганде показало, что по сравнению только с клиническим мониторингом измерение числа лимфоцитов CD4 снижало риск новых заболеваний из числа критериев СПИДа и смерти за 3-летний период, но дополнительное определение вирусной нагрузки к дальнейшему снижению заболеваемости и смертности не привело. Сегодня проходят рандомизированные исследования в Таиланде, Уганде и Зимбабве.
Преимущества обязательного измерения вирусной нагрузки — высокая чувствительность и специфичность выявлении неудачи APT и сбор подробных данных об ответе пациентов на лечение. Из-за дороговизны вирусологических исследований многие страны не могут проводить обязательный мониторинг вирусной нагрузки, но по мере совершенствования технологий этот вопрос, скорее всего, будет решен. Сегодня существует огромная потребность в недорогих количественных и полуколичественных тест-системах для выявления реактивации вируса. Экономическая эффективность измерения вирусной нагрузки будет зависеть от влияния результатов на выживаемость, заболеваемость и устойчивость, сокращение частоты неоправданных замен терапии, затрат, связанных с повышенным использованием схем второго ряда, и затрат на само определение вирусной нагрузки. Одно исследование в Южной Африке показало, что обязательное измерение вирусной нагрузки будет экономически эффективным, а другое — нет. Для выяснения этого вопроса нужны дополнительные исследования. Сравнений обязательного и выборочного мониторинга не проводилось, поэтому их относительная экономическая эффективность неизвестна.
Измерение вирусной нагрузки используется также для оценки соблюдения режима APT. В этом случае у лиц с вирусологической неудачей лечения проводят меры по улучшению соблюдения режима терапии и, если вирусная нагрузка снижается, продолжают лечение прежней схемой. Сообщается, что такая тактика приводит к подавлению вирусной нагрузки в 70% случаев, однако устойчивость ответа и частота развития устойчивости к НИОТ неизвестны. Необходимы более длительные проспективные исследования с оценкой вирусной нагрузки и лекарственной устойчивости.
Частота измерений вирусной нагрузки и показания к замене терапии
Два ключевых вопроса, касающихся тактики измерения вирусной нагрузки, заключаются в следующем: как часто измерять нагрузку и какой уровень считать показанием к замене терапии?
В странах с высокими доходами ряд когортных исследований с участием пациентов, получавших в основном схемы с неусиленными ингибиторами протеазы, показал, что иммунологическое прогрессирование ВИЧ-инфекции маловероятно, если вирусная нагрузка меньше 10 000—20 000 копий/мл либо снизилась на 1,5 lg копий/мл или более от исходного уровня. Кроме того, показано, что риск прогрессирования болезни и смерти ниже, если вирусная нагрузка менее 10 000—20 000 копий/мл. К сожалению, единственное рандомизированное исследование по этому вопросу (в котором пациенты были разделены на группу немедленной замены APT и группу отложенной замены) не завершено.
С другой стороны, нет сомнений, что мутации устойчивости накапливаются даже при низкой концентрации РНК ВИЧ в плазме. Когортные исследования с участием пациентов, получавших недостаточно эффективные схемы на основе ингибиторов протеазы, показали, что скорость накопления мутаций лекарственной устойчивости не зависела от вирусной нагрузки, хотя в одном исследовании обнаружено, что скорость развития устойчивости была выше у пациентов с умеренной виремией (3—4 log копий/мл).120 В целом мутации устойчивости за 6—14 мес. возникли у 39—77% пациентов, при этом частота новых мутаций устойчивости составила 0,93115 и 1,96119 за 6 мес. и 1,61 мутации в год.
Переносить эти данные на всех пациентов, получающих схемы с ННИОТ в СНСД, нельзя, несмотря на то что в этих схемах используются в основном те же НИОТ, что и в описанных когортных исследованиях. Многофакторный регрессионный анализ данных кооперированного исследования PLATO с включением пациентов с неудачей трехкомпонентных схем и стабильной вирусной нагрузкой показал отрицательную динамику числа лимфоцитов CD4 при использовании схем на основе ННИОТ (—23/мкл в год; 95% ДИ от —35 до —11) и положительную динамику при использовании схем на основе ингибиторов протеазы (+18/мкл в год; 95% ДИ от +7 до +28).107 Кроме того, устойчивость к ННИОТ может быть теснее связана с повышенной смертностью58, и меньше влиять на жизнеспособность вируса, чем устойчивость к ингибиторам протеазы. По данным кооперированного исследования ART-LINC, у пациентов, получавших схемы без ингибиторов протеазы (в основном, это были схемы на основе ННИОТ), вероятность иммунологического ответа при сохранявшейся в начале APT виремии была ниже. Другие исследования в СНСД показали быстрое накопление мутаций лекарственной устойчивости после вирусологической неудачи схем на основе ННИОТ,а также связь между мутациями устойчивости и последующей иммунологической неудачей. Связана ли вирусная нагрузка с накоплением мутаций устойчивости в этих условиях — неясно.
В отсутствие более подробныхданных определить оптимальную частоту измерения вирусной нагрузки нельзя. Эта частота может зависеть от таких факторов, как длительность и соблюдение режима терапии, длительность подавления вирусной нагрузки, однако в целом оптимально, по-видимому, измерять вирусную нагрузку 1 раз в 3—12 мес. В текущих рекомендациях ВОЗ схему APT первого ряда предлагается менять на схему второго ряда при уровне РНК ВИЧ > 10 000 копий/мл.
Генотипические исследования лекарственной устойчивости ВИЧ
Исследование чувствительности вируса при неэффективности лечения позволяет скорректировать лечение и улучшить вирусологический ответ. Генотипическое исследование устойчивости в странах с высоким доходом показало себя экономически эффективным. Польза от тестирования увеличивается, когда оно подкреплено консультацией эксперта, однако во многих случаях достаточно бывает использования доступных алгоритмов интерпретации результатов генотипирова-ния. В СНСД экономическая эффективность гено-типирования отличается от таковой в развитых странах в зависимости от принятой тактики мониторинга и лечения. У значительной части больных с вирусологической неудачей схем первого ряда мутации устойчивости не обнаруживаются.Это означает, что проведение тестирования выборочным методом (т.е. у тех пациентов, у которых причиной неудачи не является плохое соблюдение режима терапии) может снизить затраты на исследование. Исследование устойчивости сегодня стоит довольно дорого (от 50 до 300 дол. США за 1 тест), но затраты на него можно снизить, если применять методики, выявляющие наиболее распространенные мутации, чтобы установить, что неудача лечения связана с устойчивостью, а не с плохим соблюдением режима терапии.
Стратегии мониторинга и замены терапии во многом зависят от препаратов, включаемых в схемы первого и второго ряда. Данных для разработки рациональной тактики недостаточно даже в отношении текущих схем терапии. Считается, что при неэффективности терапии у больных быстро развивается устойчивость к ННИОТ и ламивудину или эмтрицитабину. Таким образом, ключевой вопрос — какая стратегия мониторинга и замены терапии экономически наиболее эффективным образом сократит частоту необоснованных замен терапии, среднесрочных и отдаленных случаев клинического и иммунологического прогрессирования инфекции и развития перекрестной устойчивости к ингибиторам обратной транскриптазы (обусловленной мутациями устойчивости к аналогам тимидина (ТАМ), K65R, Q151M, вставками Т69 и мутациями, снижающими эффективность ННИОТ второго ряда). Поскольку в разных СНСД условия разные, то и ответы, по-видимому, будут разными. Требуются подходы, учитывающие конкретные условия и опирающиеся на достоверные данные.
Какие использовать схемы второго ряда?
Эффективность схем второго ряда зависит от применявшейся схемы первого ряда, длительности репликации вируса на фоне лечения и возможностей выбора препаратов для схемы второго ряда. На развитие устойчивости может влиять подтиповой полиморфизм участков, связанных с появлением мутаций устойчивости, однако большого влияния на результаты лечения он, по-видимому, не оказывает.
Сегодня данных, на которые можно было бы опираться в выборе схем второго ряда в СНСД, недостаточно. Клинические наблюдения показывают, что НИОТ могут быть полезными даже при подтвержденной устойчивости, что, по-видимому, связано со снижением жизнеспособности мутантного вируса. Поэтому, если других препаратов нет, НИОТ продолжают включать в схемы второго ряда даже при устойчивости к ним. Усиленные ритонавиром ингибиторы протеазы дают впечатляющие результаты в составе схем второго ряда в странах с высоким доходом.Высокие сывороточные концентрации и большой барьер устойчивости снижают потребность во включении в схему других препаратов, сохраняющих полную активность против вируса. Учитывая это, а также переносимость, простоту применения и доступность некоторых комбинированных препаратов, в рекомендациях ВОЗ для общественного здравоохранения сегодня предлагается назначать усиленный ингибитор протеазы сдвумя НИОТ.
Выбор нукдеозидного ингибитора обратной транскриптазы
Выбор НИОТ для схемы второго ряда зависит от состава схемы первого ряда (рис. 1). При неэффективности схем первого ряда, содержащихзидовудин или ставудин, происходит отбор штаммов с мутациями ТАМ, обычно одного из двух типов: ТАМ1 (M41L, L210WhT215Y) или ТАМ2 (D67N, K70R, T215F и K219Q/E). Если ставудин используется в комбинации с препаратами с низким барьером устойчивости, высока вероятность ТАМ1.
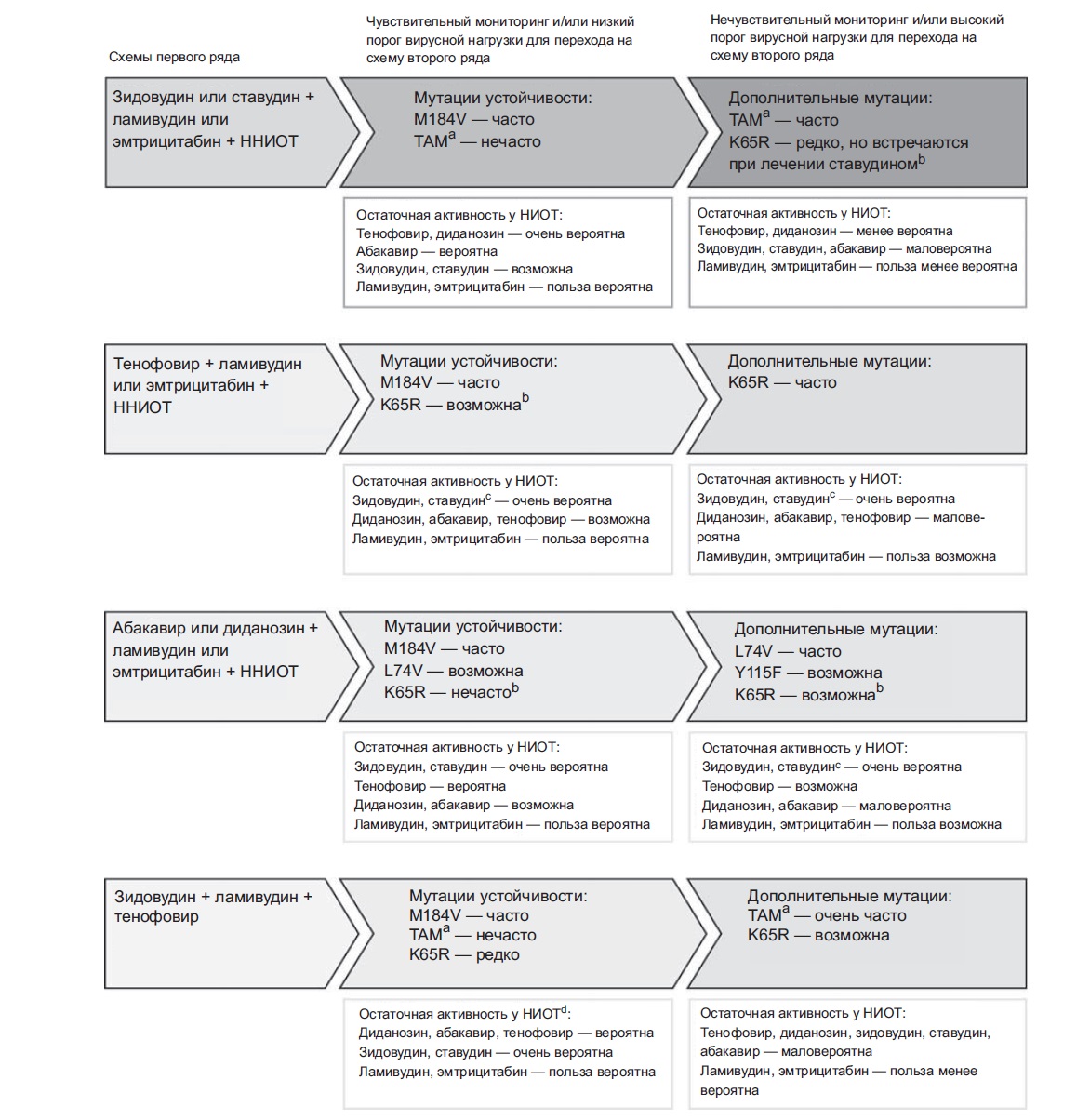
Рис. 1. Влияние схемы первого ряда и тактики мониторинга и замены APT на активность НИОТ в составе схем второго ряда. аМутации ТАМ1 (M41L, L210W, T215Y) больше влияют на активность НИОТ, чем ТАМ2 (D67N, K70R, T215F, K219Q/E). ЬУ вируса подтипа С риск мутаиии K65R может быть выше. сАанных об активности ставудина в присутствии мутаиии K65R меньше. d Имеются единичные данные о ранней неэффективности этой схемы
Накопление двух мутаций ТАМ1 или более очень тесно коррелирует с широкой перекрестной устойчивостью к НИОТ и делает создание активной схемы второго ряда на основе НИОТ невозможным.149 150 Комбинации с ла-мивудином или эмтрицитабином, которые приводят к отбору штаммов с мутацией M184V, или комбинации из НИОТ с высоким барьером устойчивости, такие как зи-довудин + ламивудин или эмтрицитабин + тенофовир, могут задерживать появление мутаций ТАМ.151 Однако при неполном подавлении репликации вируса множественные мутации ТАМ и широкая перекрестная устойчивость к НИОТ неизбежны при лечении любыми схемами, включающими аналоги тимидина.70,152
Мутация гена обратной транскриптазы ВИЧ-1 K65R, придающая вирусу полирезистентность, чаще всего бывает связана с тенофовиром, но развивается и при лече-ниидиданозином, абакавиром и, реже, ставудином.153,154 В клинических исследованиях тенофовира, в которых проводился частый вирусологический мониторинг, распространенность этой мутации у пациентов с ВИЧ подтипа В составляла менее 5%.46 Мутации ТАМ и L74V в присутствии мутации K65R появляются редко.155 В одном из недавних исследований, в котором больные с мутацией K65R наблюдались в течение 18 мес., дополнительных мутаций множественной устойчивости к аналогам нуклеозидов (Q151M или вставки Т69) не возникло.156 Данные in vitro показывают, что сочетание мутаций K65R и M184V, наблюдающееся при неэффективности тенофовира в сочетании с ламивудином или эмтрицитабином, снижает способность вируса к репликации.157 Мутации K65R и M184V повышают чувствительность вируса кзидовудину,158 при этомдля развития устойчивости к препарату требуется несколько дополнительных мутаций. Это служит основанием для использования зидовудина при неэффективности тенофовира в сочетании с ламивудином или эмтрицитабином. Хотя лабораторных данных по ставудину мало, некоторые клинические данные свидетельствуют, что он обладает сходными свойствами с зидовудином. Есть одно «но»: предварительные данные исследований in vitro показали, что у вирусов подтипа С мутация K65R встречалась чаще, чем у ВИЧ подтипа В159, и что у пациентов с подтипом С эта мутация часто наблюдалась при неэффективности схем, основанных на диданозине или ста-вудине.
Учитывая вышесказанное, после применения схем первого ряда с зидовудином и ламивудином или эмтрицитабином остаточная эффективность НИОТ в схемах второго ряда может быть больше, чем после использования схем, содержащих ставудин; при этом тенофовир может быть эффективным препаратом второго ряда в зависимости от распространенности мутаций множественной устойчивости к НИОТ и K65R. Кроме того, есть также данные, свидетельствующие в пользу назначения аналогов тимидина после тенофовира. Ламивудин и эмтрицитабин могут быть полезны в составе схем второго ряда, т. к. гарантируют определенную степень эффективности даже в отсутствие возможности исследовать чувствительность к ним, при этом они недороги и малотоксичны. Продолжение лечения аналогами тимидина и
тенофовиром может повышать шансы эффективности лечения в отсутствие исследований чувствительности к препаратам и подавлять развитие новых мутаций. Альтернативой тенофовиру служит диданозин и абака-вир, но токсичность первого и дороговизна второго делают их менее предпочтительными. Кроме того, мутация М184 повышает чувствительность ктенофовиру, но усиливает устойчивость к абакавиру и, в меньшей степени, кдиданозину.
Выбор усиленного ингибитора протеазы
В составе схем второго ряда ингибиторы протеазы, усиленные ритонавиром, нашли широкое применение,161,162 в странах с высоким уровнем дохода эти препараты успешно используются в составе резервных схем терапии.121 Сравнение данных усложняется различием доз, исследуемых популяций и оцениваемых исходов.163 Прямые сравнения усиленных ингибиторов протеазы в составе схем второго ряда в СНСД не проводились. Первые данные когортных исследований без общего доступа к измерению вирусной нагрузки показали хорошие краткосрочные результаты, свидетельствуя, что усиленный ингибитор протеазы обеспечивал основной эффект лечения.13,25 Выбор ингибитора протеазы в основном диктуется ценой и требованиями к хранению препарата. Так, сегодня лопинавир/ритонавир — единственный усиленный ингибитор протеазы, который не нужно хранить в холодильнике. Когда появится ритонавир-усилитель в лекарственной форме, устойчивой к теплу, в СНСД можно будет использовать и другие комбинации препаратов. Например, в схемах второго ряда атазана-вир/ритонавир не уступает в эффективности лопи-навиру/ритонавиру, меньше нарушает липидный профиль и допускает однократный прием в сутки.146 В схемах второго ряда дарунавир/ритонавир показал не меньшую эффективность и сходную переносимость по сравнению с контрольным ингибитором протеа-зы/ритонавиром164 и лопинавиром/ритонавиром.147 ВОЗ позиционирует лопинавир/ритонавир и атазана-вир/ритонавир какглавные ингибиторы протеазыдля схем второго ряда в СНСД.165
Альтернативные подходы
Другим подходом к лечению больных с неэффективностью схем на основе ННИОТ может быть монотерапия усиленным ингибитором протеазы. Этот подход теоретически весьма привлекателен для СНСД, т. к. его эффективность не зависит от перекрестной устойчивости к препаратам первого ряда, исключает токсичность НИОТ и снижает затраты на лечение. Однако опыт говорит о том, что этот метод менее эффективен, чем стандартные схемы на основе усиленного ингибитора протеазы,166168 и что монотерапия лопинавиром/ритонавиром бывает неэффективна против не-В-подтипов вируса.169 Схемы из двух ингибиторов протеазы также исключают проблемы, связанные с перекрестной устойчивостью к препаратам первого ряда. В ряде небольших исследований получены обнадеживающие фармакокинетические и ранние клинические результаты, но обнаружена существенная токсичность таких схем.170 172 Таким образом, имеющиеся данные не поддерживают использование схем второго ряда, состоящих только из ингибиторов протеазы.
Еще один путь сократить затраты на лечение в СНСД — снизить дозы препаратов. Изучение различных доз препаратов и постлицензионные клинические исследования показали, что добиться адекватного вирусологического ответа можно, используя меньшие дозы ин-динавира/ритонавира,173,174 лопинавира/ритонавира175 и анатазанавира,176 чем лицензированные в настоящее время. Хотя такая тактика снижает и затраты, и токсичность, она требует более строгого соблюдения режима терапии и хорошо организованных исследований безопасности и эффективности для тщательной оценки риска неэффективности лечения и устойчивости вируса.
В литературе опубликован ряд исследований прерывистой терапии, когда перерывы в лечении делают через определенные промежутки времени или при достижении определенного числа лимфоцитов CD4.177 Хотя некоторые наблюдения, в которых терапия возобновлялась при относительно высоком числе лимфоцитов CD4, показали допустимость такого подхода,42,178 исследования Trivacan и DART свидетельствовали о росте заболеваемости, a SMART выявило, что перерывы в лечении на основании числа лимфоцитов CD4 приводили к росту смертности, числа оппортунистических инфекций и тяжелых сердечно-сосудистых, почечных и печеночных осложнений.37 39 Таким образом, такой подход рекомендовать нельзя, и дополнительные клинические доводы в его пользу вряд ли будут найдены.
Недавние исследования дали обнадеживающие результаты применения ингибиторов интегразы,179,180 блока-торов CCR5-penTopoB181183 и новых НИОТ184 и ННИ-ОТ185 для резервной терапии. В странах с высоким доходами на эти препараты возлагаются большие надежды. Хотя потребность в широком доступе к препаратам третьего ряда в СНСД в ближайшие годы маловероятна,186 новые препараты позволят создавать эффективные схемы второго ряда из классов, не входящих в схемы первого ряда, что сократит вред от запоздалой диагностики неэффективности схем первого ряда и перекрестной устойчивости к НИОТ и ННИОТ. В СНСД наибольшее значение будут иметь правильно организованные исследования эффективности такого подхода у больных с не-В-подтипом ВИЧ.
Заключение
Глобальная программа по развертыванию APT «3 к 5» перешла в новую фазу, в которой упор смещается на обеспечение стабильности, что связано с существенным ростом затрат на препараты, поскольку все больше больных нуждаются в препаратах второго ряда.2,187 Важным шагом для решения этих вопросов является снижение цен на ингибиторы протеазы для СНСД,22,188 однако этой меры, скорее всего, будет недостаточно.
Для максимальной терапевтический эффективности APT и сокращения затрат необходим комплексный и долгосрочный подход к ее проведению. Для разработки такого подхода важно учесть такие параметры, как ранние исходы лечения, развитие и передача лекарственной устойчивости, отдаленная заболеваемость и смертность, а также затраты на лечение.
Таблица 2. Основные сведения о рациональном использовании антиретровирусной терапии в странах с низким и средним доходом

Таблица 3. Основные пробелы в информации о рациональном использовании антиретровирусной терапии в странах с низким и средним доходом