Сегодня 85% новых случаев ВИЧ-инфекции обусловлено передачей вируса от мужчины к женщине половым путем.
Между тем роль иммунной системы в защите от инфекций, передающихся половым путем, изучена мало, так же как и вопрос, каким образом у женщин эта роль сочетается с созданием условий для деторождения. Проанализировав возможные пути ускользания ВИЧ от иммунной защиты женской половой системы, мы пришли к неожиданному выводу, что во время менструального цикла существует период повышенного риска инфицирования ВИЧ (7—10 сут после овуляции). Во время этого периода половые гормоны подавляют функции неспецифического, гуморального и клеточного иммунитета, создавая благоприятные условия для оплодотворения. Иммунная защита ослабевает как в верхних (маточные трубы, матка, надвлагалищ-ная часть шейки матки), так и нижних (влагалищная часть шейки матки и влагалище) отделах женской половой системы. В это же время происходит пролиферация клеток, которые могут быть инфицированы ВИЧ, а также увеличивается количество клеточных рецепторов, посредством которых вирус проникает в клетки; как следствие, вся женская половая система становится уязвимой для ВИЧ независимо от маркеров клеточной и гуморальной защиты, определяющихся в крови. Для понимания иммунной защиты против ВИЧ необходимо изучить гормональную регуляцию гуморального, клеточного и неспецифического иммунитета в женской половой системе.
Необходимость в понимании взаимодействия иммунной и эндокринной функций в женской половой системе
Несмотря на беспрецедентные усилия, предпринимаемые учеными во всем мире, проблема ВИЧ-инфекции далека от разрешения. Эпидемия ВИЧ-инфекции не имеет равных по скорости распространения, масштабу и степени воздействия на людей. С момента первых сообщений о СПИДе в 1981 г. мир столкнулся с огромным числом инфицированных и умерших от этого заболевания. Приближающееся к 25 млн число летальных исходов, а также 33,2 млн инфицированных (из которых 15,4 млн — женщины) скоро сделают ВИЧ-инфекцию самой тяжелой из всех пандемий.1
Принимая во внимание неудачные результаты недавних клинических исследований влагалищных диафрагм, вакцины производства Merck и геля Microbicide,2 6 а также то, что на каждого больного, получающего антиретровирусную терапию, приходится 6 новых случаев заражения ВИЧ,7 вопрос о том, когда появится безопасная и эффективная защита от этого заболевания, остается неясным. Во время влагалищного полового акта риск передачи инфекции от мужчины к женщине примерно в 2 раза выше по сравнению с риском передачи инфекции от женщине к мужчине.8 С каждым годом число ВИЧ-инфицированныхженщин растет. В частности, в странах Африки, расположенных южнее Сахары, женщины и девушки составляют примерно 57% всех ВИЧ-инфицированных, а среди 15—24-летних — 76%.9 В США доля женщин среди ВИЧ-инфицированных увеличилась с 7% в 1985 г. до 28% в 2005 г.18
За последние 25 лет трагедия СПИДа значительно повысила интерес к изучению иммунной защиты репродуктивной системы, особенно иммунного ответа слизистой оболочки.10 Трудно понять, почему, несмотря на 20 млн ВИЧ-инфицированных женщин, частота заражения ВИЧ на 1 половой акт остается низкой — от 1: 122 до 1:1000.11,12 Хотя риск заражения зависит от вирусной нагрузки,13 времени контакта с вирусом14 и наличия других заболеваний, передающихся половым путем (ЗППП), можно предполагать существование периода особой уязвимости, в который может происходить инфицирование ВИЧ, а также, возможно, другими ЗППП.
Чтобы понять иммунный ответ женской репродуктивной системы (ЖРС) на инфицирование патогенными микроорганизмами, необходимо учесть ежемесячные циклические изменения слизистой оболочки. В ЖРС выделяют пять анатомических структур: маточные трубы, матка, над влагалищная и влагалищная части шейки матки (эндоцервикс и экзоцервикс соответственно) и влагалище. Функции всех этих структур координированы и регулируются эстрадиолом и прогестероном. Механизмы синхронизации функций всех отделов ЖРС, необходимой для создания оптимальных условий для оплодотворения, имплантации и беременности, изучены в многочисленных исследованиях.
Наша рабочая гипотеза
Критическое условие для репродуктивной функции — способность иммунной системы различать аллогенные сперматозоиды, семиаллогенную фетальную часть плаценты, с одной стороны, и патогенные микроорганизмы — с другой. Именно здесь кроется ключ к пониманию событий, происходящих при передаче ВИЧ от мужчины к женщине через слизистые оболочки половых органов. Как и другие исследователи, мы изучали компоненты иммунной защиты ЖРС от патогенных микроорганизмов и влияние на них половых гормонов.1618 Недавно мы начали исследовать физиологические механизмы ЖРС, которые могут вести к увеличению риска инфицирования ВИЧ. Это привело нас к вопросу: какой период в менструальном цикле является наиболее уязвимым в отношении вирусной инфекции?
Исследуя множество иммунных параметров, описанных ниже, мы пришли к выводу, что в течение менструального цикла существует период длительностью 7—10 дней, когда важные компоненты неспецифического, гуморального и клеточного иммунитета подавлены эстрадиолом и/или прогестероном, что повышает риск вирусной инфекции. Наша рабочая гипотеза заключается в том, что снижение иммунной защиты в верхнем и нижнем отделах ЖРС является неотъемлемой частью физиологических процессов, лежащих в основе успешного репродуктивного процесса. Кроме того, подавление иммунитета совпадает с пролиферацией клеток-мишеней ВИЧ, а также с увеличением количества рецепторов, посредством которых вирус проникает в эти клетки.
Распространенные заблуждения о женской половой системе
Первыми в списке ошибочных мнений стоят те, которые длительное время мешали научным исследованиям ВИЧ. Во-первых, считалось, что единственное значимое место инфицирования ВИЧ — слизистая оболочка влагалища и влагалищная часть шейки матки. Недавние наблюдения 19 21 позволяют сделать вывод, что над-влагалищная часть шейки матки и матка также могут быть местом проникновения ВИЧ. Второе заблуждение заключается в том, что верхний отдел ЖРС является стерильным. В действительности в нем постоянно присутствуют симбиотические и патогенные микроорганизмы, находящиеся в нижнем отделе ЖРС. Меченые микросферы альбумина и красители, а также сперма-
тозоиды в течение нескольких минут после помещения во влагалище поступают в матку и маточные трубы.22 25 Поскольку ВИЧ в сперме может быть связан или не связан с клетками или со сперматозоидами,26 27 вирус с легкостью распространяется по всей ЖРС в течение нескольких минут после попадания во влагалище. Третье заблуждение — это то, что в ЖРС отсутствуют организованные лимфатические фолликулы и что в ЖРС не происходит инициирования иммунного ответа. На самом деле такие фолликулы есть в матке, а находящиеся в ЖРС антиген представляющие клетки могут представлять антиген девственным лимфоцитам и Т-клеткам памяти.28 31 Установлено также, что введение во влагалище агонистов То11-подобных рецепторов усиливает иммунную защиту сильнее по сравнению с вакцинами.32 Четвертое заблуждение заключается в том, что гормональный фон не влияет на иммунную защиту в ЖРС. В действительности же большинство аспектов иммунной защиты ЖРС регулируется гормонами.18 И наконец, еще одно заблуждение, что иммунные клетки ЖРС идентичны циркулирующим в крови. Как в отношении фенотипа, так и иммунной функции подгруппы лейкоцитов крови (включая нейтрофилы, естественные киллеры — NK-клетки, моноциты и Т-лимфоциты) созревают и дифференцируются вскоре после поступления в ЖРС, приобретая отличия от таких же типов клеток в крови.18,33,34
Изменения уровня гормонов в крови в течение менструального цикла и последствия этих гормональных эффектов в ЖРС хорошо изучены. Под влиянием гипоталамо-гипофизарной системы уровень эстрадиола, который остается низким в первой половине менструального цикла (пролиферативная фаза), возрастает и достигает пика за 2—3 дня до овуляции (рис. 1). После овуляции уровень эстрадиола снижается, а затем снова нарастает вместе с прогестероном в течение 7—10 дней (секреторная фаза), после чего уровни обоих гормонов снижаются и наступает менструация. Обусловленные гормонами изменения во влагалище и шейке матки обеспечивают оптимальные условия для выживания и миграции сперматозоидов в маточные трубы, где происходит оплодотворение. Поддействием гормонов регулируется движение яйцеклетки в маточную трубу, обеспечивается питательная среда для нее и условия для пребывания оплодотворенной яйцеклетки в маточной трубе в течение 3—4 дней. Под влиянием эстрадиола и прогестерона в матке создаются условия для имплантации и развития оплодотворенной яйцеклетки. Наряду с репродуктивными функциями половые гормоны регулируют иммунную систему в ЖРС таким образом, чтобы она обеспечивала защиту от патогенных микроорганизмов (включая ВИЧ), не отторгая сперматозоиды, зиготу и бластоцисту.
Иммунная зашита в матке и маточных трубах
На рис. 2 схематично изображено, как половые гормоны регулируют иммунные функции в матке и маточных трубах. На рис. 2, а представлены ключевые иммунные механизмы: миграция иммунных клеток, цитотоксическая активность Т-клеток, экспрессия корецепторов, секреция антител и факторы неспецифического иммунитета. Каждый из этих факторов играет важную роль в физиологических механизмах защиты репродуктивной системы.
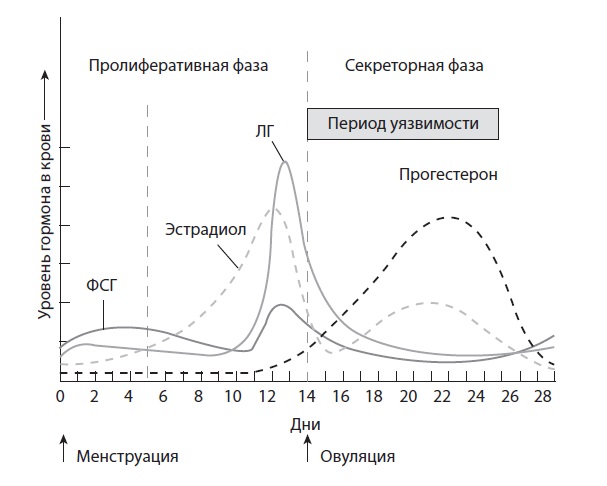
Рис. 1. Относительные изменения уровня эстрадиола и прогестерона во время пролиферативной и секреторной фаз менструального цикла. Отмечен предполагаемый период уязвимости, приходящийся на 14-23-й день. ФСГ — фолликулостимулирующий гормон; ЛГ — лютеинизирующий гормон
На рис. 2, показано влияние половых гормонов на иммунные функции. Расходящиеся кольца соответствуют эстрадиолу и прогестерону, уровень которых растет в середине менструального цикла и во время секреторной фазы. Эти гормоны не только усиливают миграцию иммунных клеток в матку, но и влияют на пространственное соотношение их между собой таким образом, что они образуют скопления в эндометрии.29 В сердцевине этих скоплений находятся В-клетки, окруженные лимфоцитами CD8 и ободком из макрофагов. В некоторых случаях скопления состоят из лимфоцитов CD4. Под действием гормонов скопления лимфоидных клетокуве-личиваются в размере от 300 до 3000—4000 клеток и во многих случаях прикрепляются кбазально-латеральной поверхности эпителиальных клеток эндометрия.29-37. White et al.38 отмечают, что во время секреторной фазы цикла в матке и маточных трубах наряду с образованием скоплений лимфоидных клеток происходит подавление активности цитотоксических лимфоцитов CD8, измеряемой методом перенаправленного лизиса. Подавление иммунитета происходит только в верхнем отделе репродуктивной системы и не сопровождается снижением числа лимфоцитов CD8 в крови. Нами обнаружено также, что цитотоксические лимфоциты матки, полученные от ВИЧ-инфицированных женщин, обладают цитотоксической активностью против ВИЧ, которая отсутствует в крови.39 В других наших исследованиях установлено, что эпителиальные клетки матки экспрессируют рецепторы CD4, CXCR4 и CCR5, причем экспрессия этих рецепторов на апикальной поверхности клеток варьирует в зависимости от фазы менструального цикла.19 Особенно интересен тот факт, что все три корецептора регулируются гормонами: их количество остается низким во время пролиферативной фазы цикла, затем оно достигает пика во время овуляции, во время секреторной фазы цикла их количество либо доходит до плато (CXCR4, CD4) либо снижается (CCR5).19 Настолько же важны результаты других исследований, показавших, что незрелые и зрелые дендритные клетки при культивировании с трансформирующим фактором роста (3 (ТФР-Р) усиливали экспрессию корецепторов (CXCR4, CCR5).40 Поскольку эстрадиол стимулирует выделение ТФР-Р в ЖРС,41 можно предположить, что он может опосредованно изменять экспрессию корецепторов в иммунных клетках ЖРС. Рис. 2, b иллюстрирует нашу гипотезу о том, что эстрадиол и прогестерон регулируют перемещение IgA или IgG из ткани в просвет матки. Это заключение основано на данных нашего исследования, свидетельствующих, что во время секреторной фазы менструального цикла повышается экспрессия рецептора, ответственного за транспорт IgA.42 Однако в обычных условиях уровень IgA и IgG в маточных секретах остается низким (указан тонкой стрелкой).
В экспериментальных исследованиях мы недавно обнаружили, что эстрадиол оказывал прямое влияние на синтез и секрецию в эпителиальных клетках (З-дефенсинов, а также секреторного ингибитора лейкоцитарной протеазы (SLPI), который обладал сильной антимикробной активностью против бактерий и вирусов.43,44 Наши эксперименты с первично поляризованными эпителиальными клетками показывают, что эстрадиол усиливает секрецию этих антимикробных веществ, подавляя в то же время секрецию провоспалительных хемокинов и некоторых цитокинов из числа агонистов То11-подобных рецепторов.44 Согласно другим нашим исследованиям,45 антимикробные вещества, секретируемые эпителиальными клетками, биологически активны и подавляют рост грамположительных и грамотрицательных бактерий (Staphylococcus aureus, Escherichia coli), а также Neisseria gonorrheae, Candida albicans и ВИЧ (X4 и R5) (Fahey et al., неопубликованные данные).
Верхний левый овал на рис. 2, b соответствует трем типам клеток неспецифического иммунитета и показывает, что эта система иммунитета подавляется при прямом и/или опосредованном воздействии эстрадиола на ТФР-Р, другие цитокины и факторы роста.16,41 Sentman et al. описывают, что NK-клетки матки (окрашивающиеся на CD56) при культивировании в присутствии маточных секретов экспрессируют относительно низкий уровень внутриклеточного интерферона-у. В условиях нейтрализации антителами к ТФР-Р в клетках, стимулированных агонистом То11-подобных рецепторов типа 3, poly 1:С, усиливается образование внутриклеточного интерферона-у в NK-клетках матки.46 Также нами обнаружено, что эстрадиол снижал экспрессию в моноцитах интерлейкина-8 (ИЛ-8), стимулированную липополисахаридом (ЛПС). Обработка моноцитов эстрадиолом перед воздействием ЛПС уменьшает стимуляцию ИЛ-8 и образование белка.47 Таким образом, эстрадиол, действуя на моноциты, подавляет миграцию нейтрофилов в ЖРС, что снижает активность неспецифического иммунитета. Наоборот, когда на макрофаги действует ЛПС в присутствии эстрадиола, секреция ИЛ-1(3 усиливается, что ведет к повышению апикальной секреции человеческого Р-дефенсина-2 эпителиальными клетками матки, а также к повышению антимикробной активности.48 В других исследованиях мы обнаружили, что, действуя на нейтрофилы, ТФР-Р подавлял дегрануляцию воспалительных клеток и снижал секрецию лактоферрина, который мог бы разрушить патогенные микроорганизмы, но в то же время и повредить яйцеклетку.49 Sato et al.40 продемонстрировали, что ТФР-Р усиливал хемотаксическую миграционную активность незрелых дендритных клеток в ответ на действие хемокинов СС и СХС, подавляя в то же время экспрессию молекул главного комплекса гистосовместимости (HLA) II класса, распознавание и презентацию антигенов.
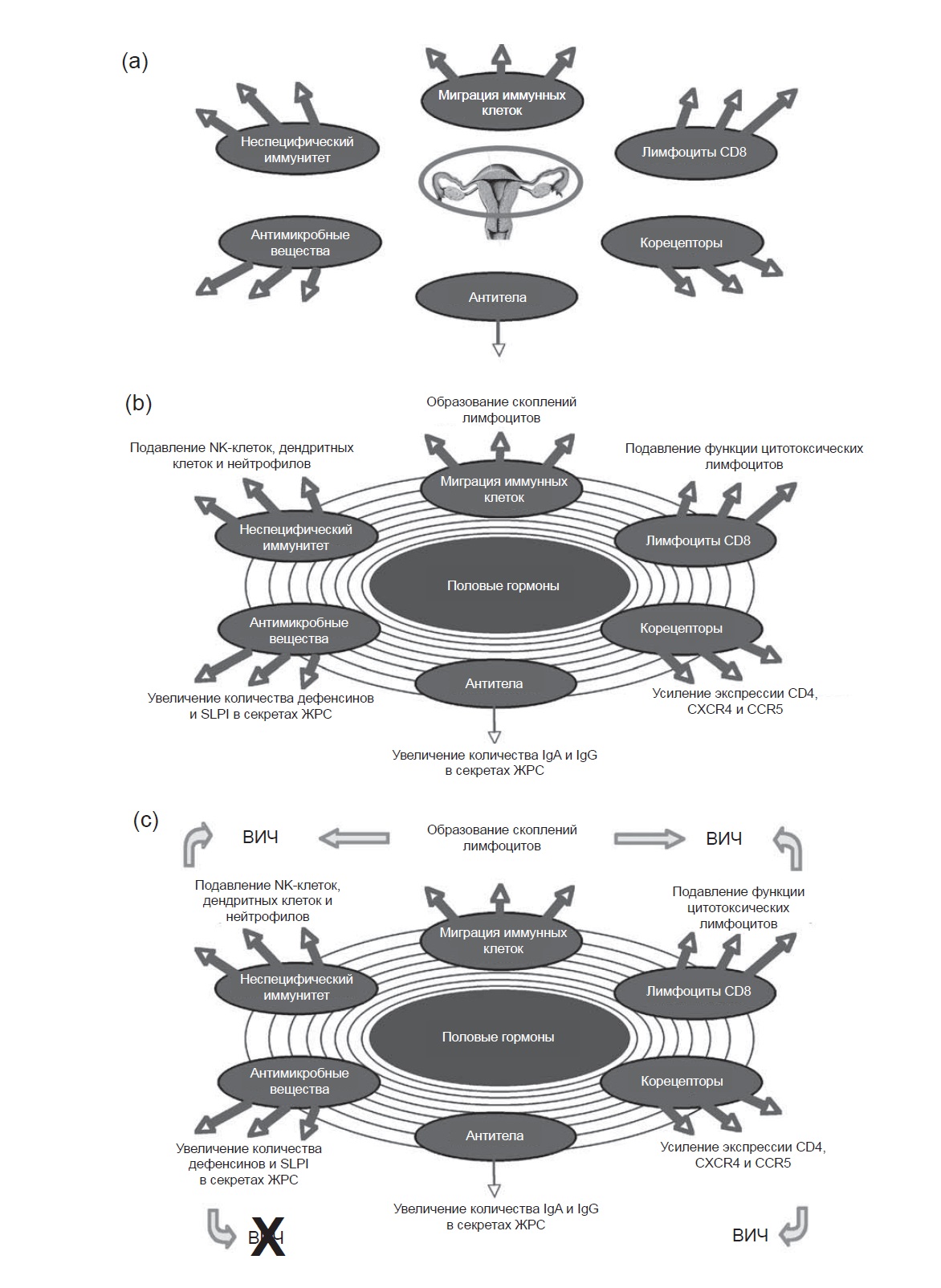
Рис. 2. Роль половых гормонов в регуляции иммунной функции в матке и маточных трубах, (а) Представлены ключевые иммунные механизмы, прямо или косвенно действующие на патогенные микроорганизмы, которые попадают в матку и маточные трубы и могут угрожать здоровью репродуктивной системы. (Ь) Показано влияние гормонов на механизмы иммунной зашиты. Расходящиеся кольца соответствуют повышению уровня эстрадиола в середине менструального никла и прогестерона во время секреторной фазы менструального никла, (с) Проиллюстрирована наша гипотеза о том, что эстрадиол и прогестерон подавляют иммунную защиту, что создает период уязвимости для ВИЧ
В экспериментах на мышах мы наблюдали, что эстрадиол подавлял презентацию антигенов эпителиальными и антигенпредставляюгцими клетками в строме матки и влагалища, снижая экспрессию HLA II класса и CD80/8650 (Wira, неопубликованные данные). Все вместе результаты этих исследований показывают, что иммунные механизмы в матке изменяются в ответ на повышение уровня гормонов во время менструального цикла.
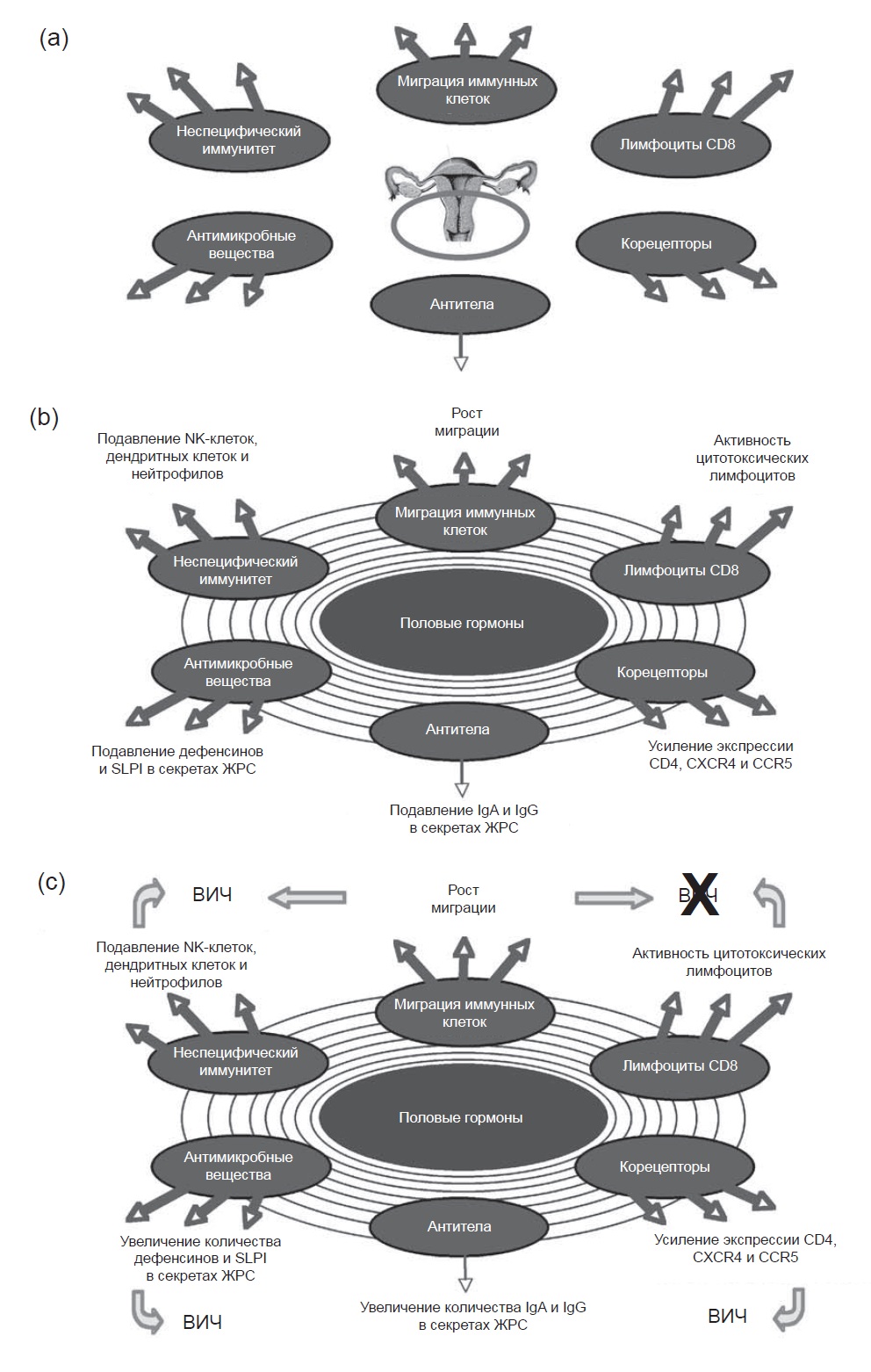
Рис. 3. Роль половых гормонов в регуляции иммунной функции в шейке матки и влагалище. Подробности см. в описании рис. 2 и в тексте
Рис. 2, с иллюстрирует нашу гипотезу о том, что половые гормоны подавляют иммунную защиту в матке, создавая тем самым оптимальные условия для оплодотворения и имплантации яйцеклетки. Однако вследствие этого возникаетуязвимость передВИЧ-инфекцией. Во-первых, за счет эпителиальных клеток и находящихся у поверхности эндометрия макрофагов и лимфоцитов CD4 возрастает количество корецепторов, посредством которых происходит инфицирование. Во-вторых, подавляются клетки системы неспецифического иммунитета (NK-клетки, нейтрофилы и дендритные клетки) и адаптивного иммунитета (лимфоциты CD8). В таких условиях для вирусной инфекции единственным препятствием остается наличие антимикробных веществ в маточных трубах, матке и эндоцервикальных секретах. Еще точно не установлено, сохраняется ли во время секреторной фазы цикла повышенное выделение антимикробных веществ, стимулированное половыми гормонами. В соответствии с нашей гипотезой рост уровня эстрадиола в середине менструального цикла, а также сохранение повышенного эстрадиола и прогестерона в секреторной фазе цикла увеличивают уязвимость перед ВИЧ и другими инфекциями.
Иммунная зашита в шейке матки и влагалища
Мы обнаружили, что в нижних половых путях под влиянием половых гормонов происходят не такие изменения иммунных механизмов, как в верхних (рис. 3). В шейке матки и влагалище во время менструального цикла миграция макрофагов, В-клеток, нейтрофи-лов28’33 и дендритных клеток меняется незначительно.51 В отличие от верхних половых путей в тканях, взятых во время пролиферативной и секреторной фаз менструального цикла, определяется активность цитотоксиче-ских Т-лимфоцитов.52 Мы полагаем, что, как и в верхних половых путях, функция NK-клеток, нейтрофилов и дендритных клеток подавляется ТФР-р, а макрофаги и дендритные клетки усиленно экспрессируют корецеп-торы ВИЧ. Особенный интерес представляет факт экспрессии корецепторов эпителиальными клетками влагалищной части шейки матки. Исследование Yeaman et al.20 показывает, что базальные и парабазальные эпителиальные клетки шейки матки экспрессируют CD4, CCR5 и GalCer в отличие от поверхностных клеток и клеток средней зоны слизистой оболочки ЖРС. Несмотря на то что циклические изменения в экспрессии не такие выраженные, как в матке, гистологические данные подтверждают, что экспрессия CD4 и CCR5 в пролиферативной фазе выше, чем в секреторной.
Другие отличия от верхних половых путей заключаются во влиянии половых гормонов на секреты эктоцер-викса и влагалища. Schumacher53 выяснил, что уровень IgA, IgG и лактоферрина в секретах половых путей снижался в 10 — 100 раз в середине цикла и нарастал только к концу цикла. Установлено, что пероральные контрацептивы подавляют уровень иммуноглобулинов и лактоферрина. Согласно другим исследованиям, в шеечной слизи, взятой за 5 дней до и через 3 дня после овуляции, обнаруживается двухфазный характер нарастания уровня IgA и IgG — пик перед овуляцией и небольшое увеличение после овуляции.54 Nardelli-Haefliger et al.55 установили, что в середине овуляторного цикла титры IgG к частицам, подобным вирусу папилломы человека типа 16, снижались в шеечных секретах примерно в 9 раз. Эти изменения, по-видимому, не должны усиливать риск вирусной инфекции у пациентов с нормальной иммунной системой, но могут снижать резистентность у лиц с индуцированным иммунным ответом против ВИЧ. Важно отметить, что в середине цикла происходит снижение уровня лактоферрина, выделяемого нейтрофилами, который подавляет ВИЧ.56 Недавно мы обнаружили, что в середине цикла поддействием эстрадиола также уменьшается содержание эндогенных антимикробных веществ в цервиковагинальных смывах (ЦВС).56 Измерение концентрации цитокинов, хемокинов и антимикробных веществ в ЦВС показывает, что уровень SLPI, человеческого р-дефенсина-2, пептида нейтрофилов человека типа 1—3 и лактоферрина значительно снижается в середине цикла (13-й день), остается низким в течение 7—10 дней и возвращается к значению в пролиферативной фазе непосредственно перед менструацией. Уровень общего белка и ТФР-р, наоборот, остается на протяжении менструального цикла неизменным. В других исследованиях во время секреторной фазы менструального цикла в ЦВС обнаружен наивысший уровень человеческого интестинального дефенсина-5.57 Недавно Cole et al. продемонстрировали, что катионные полипептиды в вагинальной жидкости обладали активностью против ВИЧ (Х4 и R5), кроме того, между полипептидами и белками в вагинальной жидкости существовал синергизм.58 60
Остается неясным, действуют ли половые гормоны на иммунные клетки и на их секреторную функцию в нижнем отделе ЖРС непосредственно либо опосредованно, через изменения объема и состава секретов половых путей. Очевидно, что ситуация с неспецифическим иммунитетом, который физиологически подавлен в середине менструального цикла, относится и к эктоцервикаль-ной и вагинальной секреции. Учитывая, что регуляторные Т-клетки имеются во всей ЖРС и чувствительны к эстрадиолу,61 мы полагаем, что в шейке матки и влагалище наблюдается такое же подавление NK-клеток и дендритных клеток, как и в матке. На рис. 3, с представлена наша концепция уязвимости нижних половых путей перед ВИЧ в середине и секреторной фазе менструального цикла.
Учитывая широкий спектр физиологической иммуносупрессии в цервиковагинальных секретах, защита в эктоцервиксе и влагалище, по-видимому, зависит от цитотоксических Т-лимфоцитов. Несмотря на то что миграция иммунных клеток может увеличивать защиту, дальнейшее подавление функции иммунных клеток (NK-клеток, дендритных клеток) наряду с усиленной экспрессией корецепторов повышает риск ВИЧ-инфекции.
Влияние пероральных контрацептивов и менопаузы на уязвимость перед ВИЧ
В распространении ВИЧ гормональные контрацептивы могут играть определенную роль. В обзоре биологических и эпидемиологических исследований, сделанном Baeten и Overbaugh, показано, что гормональные контрацептивы могут влиять на риск заражения ВИЧ и прогрессирование инфекции.62 64 Это влияние было обнаружено не во всех исследованиях; неясно также, насколько оно зависит от вида контрацептивов (комбинированные пероральные контрацептивы, формы для в/м введения и т.д.), доз гормонов и длительности применения. Наша гипотеза подтверждается наблюдениями о том, что пероральные контрацептивы усиливают экспрессию CCR5 на лимфоцитах CD4 в шейке матки, а прогестерон подавляет иммунный ответ слизистой оболочки ЖРС после интравагинального введения вируса простого герпеса 2-го типа.65,66 В других исследованиях53,55 показано, что пероральные контрацептивы нарушают циклические изменения уровня IgA и IgG, а также снижают уровень специфических антител к вирусу папилломы человека в цервикальных секретах. Меньше известно о том, насколько восприимчивость к ВИЧ-инфекции у женщин меняется в менопаузе. Распространенность ЗППП среди пожилых женщин позволяет предположить, что у них могут быть нарушены ключевые компоненты иммунной защиты. Мы обнаружили, что эпителиальные клетки эндометрия в менопаузе не секретируют антимикробные вещества в отличие от клеток, полученных у женщин в детородном возрасте.45 С другой стороны, мы отметили, что активность цито-токсических (CD8) лимфоцитов в тканях матки в менопаузе в 3—4 раза выше.38
Выводы
За последние 35—40 лет достигнут значительный прогресс в понимании того, как регулируется иммунная система в ЖРС для успешного выполнения репродуктивной функции. Представленные нами исследования имеют важное значение для изучения ВИЧ-инфекции. Во-первых, следует обратить внимание на всю ЖРС в целом, чтобы понять воздействия, оказываемые на иммунную систему. ВИЧ может инфицировать клетки как нижних, так и верхних половых путей. Исследования, сосредоточенные исключительно на нижних половых путях, могли пропустить патофизиологические процессы, связанные с ВИЧ-инфекцией. Во-вторых, незначительные колебания уровня гормонов оказывают сильное влияние на неспецифический и специфические иммунитет. Игнорирование этих изменений может иметь катастрофические последствия для интерпретации результатов, особенно когда гормоны применяются для моделирования инфекции в экспериментах на животных, т.к. непрерывное введение половых гормонов в фармакологических дозах может привести к ложным заключениям. В-третьих, иммунные клетки в ЖРС (NK-клетки, макрофаги, Т-клетки и нейтрофилы) отличаются от таких же клеток крови, поэтому последние не могут использоваться в качестве суррогатных маркеров иммунной функции ЖРС. Наконец, учитывая быстроту развития ВИЧ-инфекции, эффективная вакцина для защиты от заражения при гетеросексуальных контактах должна воздействовать на гуморальный, клеточный и неспецифический иммунитет, поскольку в физиологических условиях все они, взаимно дополняя друг друга, обеспечивают защиту от инфекции.
В заключение отметим, что обнаруженный нами период уязвимости перед ВИЧ, существующий в течение 7—10 дней, когда половые гормоны подавляют компоненты неспецифического, гуморального и клеточного иммунитета, дает возможность разработать экспериментальные подходы к восстановлению необходимой защиты без нарушения репродуктивной функции. Проведено и будет проводиться множество исследований вакцин и антимикробных препаратов. Основываясь на понимании механизмов ускользания ВИЧ от иммунной защиты слизистой оболочки ЖРС, исследования должны учитывать флюктуации неспецифического и адаптивного иммунитета ЖРС во время менструального цикла. Также необходимо уделять внимание другим факторам, таким как симбиотические микроорганизмы и pH в ЖРС, роль спермы в передаче ВИЧ. В целом эти исследования предполагают изучение подходов для устранения иммунной толерантности в ЖРС, которая развивается во время менструального цикла.