В ноябре 2007 г. крупное международное исследование Step, целью которого являлось испытание основной кандидатной вакцины среди вакцин против ВИЧ, направленных на индукцию Т-клеточного иммунитета, было прекращено в связи с установленной при проведении промежуточного анализа ее неэффективностью.
Вакцина, проходившая испытание, содержала в качестве вирусного вектора не способный к репликации аденовирус серотипа 5 (Ad5). Цель испытания — выяснить, может ли вакцина снизить риск заражения ВИЧ или уменьшить вирусную нагрузку у инфицированных лиц.3 Клинические испытания прототипа этой вакцины были начаты в 2000 г. Их результатом стало создание нескольких модификаций промоторов вирусного вектора, а также попытка повышения эффективности иммунного ответа путем добавления генов pol и nef к исходному гену gag. Окончательный вариант кандидатной вакцины содержал последовательности gag/ pol и «е/ВИЧ подтипа В. Вакцина прошла развернутую серию клинических испытаний в период с 2003 по 2006 г. Иммуногенность вакцины оценивалась методом ELISpot. Проведенные исследования продемонстрировали формирование выраженного Т-клеточного ответа у 80% вакцинированных: медиана ответа составляла 275—300 клеток, формирующих пятно (КФП), на 106 мононуклеаров периферической крови (МИК). Такая частота и уровень ответа выше, чем у всех других методов стимуляции Т-лимфоцитов, о которых сообщалось к началу исследования Step в 2005 г.4 Подробный анализ Т-клеточного ответа показал, что более чем у 60% участников с определенным с помощью ELISpot-теста иммунным ответом на вакцину вирусспецифические иммунные реакции были опосредованы лимфоцитами CD8, а примерно у 40 % — лимфоцитами CD4. Иммунный ответ сохранялся более 6 мес. после последней вакцинации.5,6 Учитывая вышесказанное, неэффективность вакцины, которая проявилась в неспособности как предупредить инфицирование, так и, в особенности, подавить репликацию вируса в случае, если заражение все же происходило, послужила основанием для распространения в научном сообществе сомнений о возможности создания эффективной вакцины против ВИЧ-инфекции.
В исследовании Step приняло участие 3000 здоровых, не инфицированных ВИЧ добровольцев. Участники были рандомизированы на две группы: первая получала плацебо, вторая — вакцину. В зависимости от титров антител к Ad5 участники, получавшие вакцину, были разделены на серонегативных к Ad5 (< 18), а также лиц с низкими (18—200), умеренными (200 — 1000) и высокими (> 1000) титрами антител. Деление на группы было основано на результатах исследований I фазы, показавших, что наличие превакцинального иммунитета к вектору вакцины снижало иммуногенность вакцины.7 Вакцинация проводилась тремя дозами вакцины: вторую дозу вводили через 1 мес. после первой, а третью — через 6 мес. После вакцинации все участники периодически проходили тестирование на ВИЧ. При положительном результате теста проводились исследования, необходимые для подтверждения ВИЧ-инфекции, и в течение 3—6 мес. измерялась вирусная нагрузка. Ко времени предварительного анализа результатов (ноябрь 2007 г.) ВИЧ заразилось 84 участника, из них 82 мужчины, среди которых почти все заразились при гомосексуальных половых контактах.8 В ходе исследования обнаружился неожиданный и приводящий в замешательство факт: среди вакцинированных мужчин с пре-вакцинальным иммунитетом к Ad5 (титр антител более 18) доля заразившихся ВИЧ оказалась вдвое больше, чем среди получивших плацебо (табл. 1). При этом среди серо-негативных к Ad5 мужчин частота заражения ВИЧ у вакцинированных и получивших плацебо была одинаковой (отношение заболеваемости у вакцинированных и получивших плацебо составило 1:1). Многофакторный анализ показал, чтоу мужчин с обрезанной крайней плотью, особенно у серо-позитивных к Ad5, частота инфицирования ВИЧ была в 4 раза выше (95%-й доверительный интервал [95% ДИ] 1,3— 11), что указывало на статистически значимо больший риск заражения ВИЧ у этой подгруппы, в частности, по сравнению с мужчинами с обрезанной крайней плотью, не имевшими нейтрализующих антител к Ad5.9
Недавно опубликованы результаты параллельного южноафриканского исследования Phambili.10 Его целью было оценить эффективность вакцины MRK ьв регионе, в котором преобладает ВИЧ подтипа С.
 В исследовании участвовал 801 человек. Из 11 заразившихся участников 9 имели нейтрализующие антитела к Ad5, из них 6 — вакцинированы, а 3 — получили плацебо. По одному участнику, заразившемуся ВИЧ, в каждой группе было исходно серонегативным к Ad5; 10 из 11 инфицированных — женщины. Эти предварительные результаты южноафриканского исследования подтверждают тот факт, что наличие иммунитета к вектору Ad5 является независимым фактором риска заражения ВИЧ среди привитых данной вакциной. В качестве плацебо в испытаниях использовался физиологический раствор, что не позволяло оценить влияние самого вектора Ad5 на заражение ВИЧ-1. Повышенный риск заражения ВИЧ-1 у лиц, имевших иммунитет к Ad5 до вакцинации, оказался непредвиденным. Ни в одном из экспериментов на обезьянах с использованием аденовирусных векторов такого феномена не отмечалось.1114
В исследовании участвовал 801 человек. Из 11 заразившихся участников 9 имели нейтрализующие антитела к Ad5, из них 6 — вакцинированы, а 3 — получили плацебо. По одному участнику, заразившемуся ВИЧ, в каждой группе было исходно серонегативным к Ad5; 10 из 11 инфицированных — женщины. Эти предварительные результаты южноафриканского исследования подтверждают тот факт, что наличие иммунитета к вектору Ad5 является независимым фактором риска заражения ВИЧ среди привитых данной вакциной. В качестве плацебо в испытаниях использовался физиологический раствор, что не позволяло оценить влияние самого вектора Ad5 на заражение ВИЧ-1. Повышенный риск заражения ВИЧ-1 у лиц, имевших иммунитет к Ad5 до вакцинации, оказался непредвиденным. Ни в одном из экспериментов на обезьянах с использованием аденовирусных векторов такого феномена не отмечалось.1114
Полученные результаты поднимают ряд важных вопросов. В частности, почему высокоиммуногенная вакцина оказалась неэффективной в подавлении репликации вируса? Однако более важным, по-видимому, является вопрос, каким образом перенесенная до вакцинации аденовирусная инфекция типа 5 повышает частоту заражения ВИЧ, т.к. от ответа на этот вопрос зависит создание других вакцин на основе аденовирусных векторов. Был ли поствакцинальный иммунный ответу заразившихся слабее, чем у незаразившихся? Были ли интенсивность, качество и диапазон иммунного ответа недостаточными? Поиск ответов на эти вопросы был начат с подробного анализа данных исследования Step.
Оценка иммунного ответа методом ELISpot проводилась в случайной выборке из 25% участников через 8 нед. от начала исследования (через 4 нед. после введения второй дозы вакцины). В исследованиях I фазы в этот период показатели иммунного ответа были близки к максимальным. В вакцинированной группе частота иммунного ответа, определенного с помощью ELISpot в МПК, у заразившихся ВИЧ была почти такой же, как у не-заразившихся. Среди исходно серо-негативных к Ad5 лиц поствакцинальные антитела к белкам группы Gag обнаруживались у 74% заразившихся и у 76% не-заразившихся; по антителам к белкам Pol эти показатели составили 63 и 73% соответственно, а по антителам к белкам Nef — 74 и 70 % соответственно.9 Среднее геометрическое (СГ) результатов ELISpot было сходным в обеих группах (~ 350 КФП/lO6 МПК). Интересно, что у лиц, имевших антитела к Ad5 до вакцинации, иммунный ответ на вакцину в исследовании Step был слабее, чем у таковых в исследованиях! Фазы (СГ~ 170 КФП/Ю6 МПК). Однако опять же никаких явных различий в иммунном ответе между заразившимися и незаразив-шимися серопозитивными к Ad5 участниками не было. Например, антитела к белкам группы Gag определялись у 46% участников, которые впоследствии заразились ВИЧ, и у 54% — незаразившихся. Важно отметить, что более 50% ВИЧ-специфичных лимфоцитов CD8, выявленных после вакцинации, вырабатывают только у-интерферон и не вырабатывают ни интерлейкина-2, ни фактора некроза опухолей, что указывает на их меньшую многофункциональность.9,15 Хотя эти данные предварительные, они четко показали, что вакцина MRK gag/pol/nef иммуногенна, что у лиц, иммунизированных этой вакциной и впоследствии заразившихся ВИЧ-1, был иммунный ответ на вакцину и что пока не выявлено никаких различий в интенсивности, качестве и диапазоне иммунного ответа между вакцинированными участниками, которые впоследствии заразились или не заразились. Таким образом, очевидно, что не существует четкой взаимосвязи между выраженностью иммунного ответа на вакцинацию и восприимчивостью к ВИЧ-инфекции. Отметим, что большинство авторитетных исследователей в этой области (включая авторов) считали маловероятным, чтобы вакцина, содержащая гены gag, pol и nef снизила восприимчивость к ВИЧ-инфекции (основные надежды возлагались на подавление репликации вируса в случае развившейся инфекции). Пока не будет разработана вакцина, стимулирующая высокую выработку нейтрализующих антител, большинство специалистов полагают, что наиболее вероятный эффект от применения вакцин, направленных на стимуляцию Т-клеточного иммунитета, будет заключаться в подавлении репликации вируса и, как следствие, снижении вирусной нагрузки и концентрации ВИЧ-1 в слизистых оболочках.
Судя по результатам исследований у обезьян, вероятность терапевтического эффекта (т.е. подавление уже развившейся инфекции)у вакцин, направленных на стимуляцию Т-клеточного иммунитета, выше профилактического.1316 Изучение взаимосвязей между уровнем и качеством Т-клеточного ответа и вирусной нагрузкой у участников исследования Step находится на начальном этапе. Несмотря на то что во всей группе различия в величине пикового и базального уровней вирусной нагрузки были небольшими, анализ полученных данных продолжается с целью выявить различий этих показателей в подгруппах. Например, у лиц с очень высоким иммунным ответом на вакцину может обнаружиться меньшая базальная вирусная нагрузка. Поскольку при планировании исследования снижение базальной вирусной нагрузки считалось наиболее вероятным эффектом вакцины, необходимо дождаться результатов полного анализа, прежде чем делать выводы о влиянии поствакцинального Т-клеточного ответа на вирусную нагрузку и динамику числа лимфоцитов CD4 в случае последующего заражения ВИЧ.
Эпитоп-специфический иммунный ответ
Одной из центральных предпосылок исследования Step было предположение о том, что на введение наиболее консервативных областей генома ВИЧ — генов gag, pol и nef— разовьется Т-клеточный иммунный ответ, который будет направлен против штаммов, циркулирующих в популяции, что приведет к снижению восприимчивости к ВИЧ и распространения заболевания.1718 В настоящее время нет данных о том, что в циркулирующих в популяции штаммах ВИЧ часто встречаются антигенные детерминанты (эпитопы), вводимые с вакциной. Другими словами, не связана ли недостаточная эффективность вакцины с недостаточным набором антигенных детерминант (эпитопов), представленных в ней? В I фазе исследований было определено среднее количество антигенных детерминант одного вида на генный продукт у большинства вакцинированных.16 Вызывает интерес тот факт, что биометрический анализ последовательности нуклеотидов в генах gag, pol и nef в MRK-вакцине указывает на наличие более 150 эпитопов в составе gag и более 50 — в составе pol и neflQ Однако почти у всех людей обнаруживается феномен иммунодоминантности эпитопов.20 Начальные данные, полученные в результате картирования эпитопов в I и II фазах испытаний, позволяют предположить, что многие эпитопы gag, введенные с вакциной, присутствуют в циркулирующих в популяции штаммах ВИЧ подтипа В. Однако эпитопный охват, т. е. состав вводимых с вакциной эпитопов, часто встречающихся в потенциально контагиозных штаммах ВИЧ, вероятно, довольно низок.19,21 Ограниченность иммунного ответа (узкий диапазон), по-видимому, является важным фактором, обусловливающим недостаточную эффективность вакцины в целом. В настоящее время F. McCutchen и J. Mullins изучают полные нуклеотидные последовательности штаммов, вызвавших инфекцию у 82 участников исследования. Дополнительно будет определен уровень вирусной нагрузки у лиц, у которых образовалось значительное количество лимфоцитов CD8, специфичных к ВИЧ-1, и у лиц, у которых такого иммунного ответа не развилось. Именно на разработке и совершенствовании вакцин, вызывающих развитие Т-клеточного ответа к многочисленным консервативным областям генома ВИЧ, должен быть сделан основной акцент в области исследований Т-клеточных вакцин.
За последние 12 мес. выдвинуто несколько предложений по дизайну ДНК-вставок, что, вероятно, приведет к изменению в вакцине набора антигенных детерминант.22 24 Пока неизвестно, будет ли такой подход способствовать преодолению иммунодоминантности, которая наблюдается при использовании современных вакцин на основе вирусных векторов. Несомненно, что в состав вакцины необходимо вводить большее число эпитопов для того, чтобы обеспечить наиболее оптимальный Т-клеточный ответ на субдоминантные Т-клеточные эпитопы.
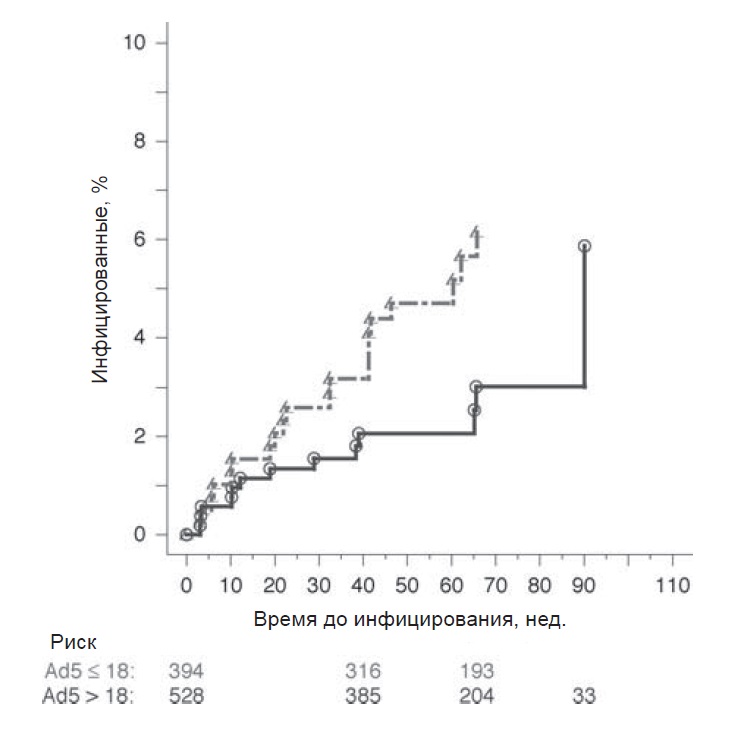
Рис. 1. Кривая Каплана-Мейера (% инфицированных) для лиц, получавших плацебо: модифицированный анализ по назначенному лечению (мужчины). Время установления ВИЧ-инфекиии (промежуточный момент между датой первого выявления инфекции и последней датой отрицательного исследования на ВИЧ) в неделях. Значение р = 0,103 (без поправок), относительный риск 1,79 (у лии с титром антител к Ad < 18 vs > 18); р = 0,207 (с поправкой по ковариатам), относительный риск 1,65 (у лиц с титром антител к Ad < 18 vs > 18)
Это обеспечит более оптимальный вакцино-индуцированный Т-клеточный ответ на различные эпитопы циркулирующих штаммов ВИЧ.21 Введение в вакцину белковых эпитопов, узнаваемых лимфоцитами CD8, выглядит наиболее привлекательным для достижения этой цели. Однако на сегодняшний день иммуногенность пептидных вакцин, вводимых в виде свободного белка или с вирусным вектором, таким как посксвирус, у людей не доказана.25 Возможно, необходимо использование альтернативных технологий для увеличения диапазона действия вакцины, основанных на введении присоединенных к адъювантам белковых субъединиц, которые способны вызывать Т-клеточный ответ.26 Последние данные свидетельствуют о том, что реиммунизация с применением вакцин с гомологичными векторами изменяет Т-клеточный ответ на вакцинацию, а также способствует повышению иммунодоминантности.27 Необходимо развивать стратегии, основанные на использовании более сложных гетерологичных векторов с гетерологичными вставками, введенными в различные участки и в разное время. Это потребует более сложных векторных комбинаций и режимов вакцинации, однако есть основания надеяться, что подобный подход расширит диапазон Т-клеточного ответа.28
Опенка качества поствакцинального Т-клеточного ответа
В последнее время некоторыми группами ученых подчеркивается, что Т-клетки, выполняющие множество функций (многофункциональные клетки), эффективнее подавляют экспериментальную вирусную инфекцию, чем клетки, действующие более избирательно.29 В некоторых работах, посвященных изучению клинического течения ВИЧ-1-инфекции, более успешный контроль за течением заболевания связывают с участием в иммунном ответе Т-клеток, особенно Т-лимфоцитов CD4, вырабатывающих интерлейкин-2 и у-интерферон.30,31 С действием многофункциональных Т-лимфоцитов связана иммунная защита при лейшманиозе, коровьей оспе и желтой лихорадке.32 34 Технологии, используемые для характеристики этих многофункциональных клеток, основаны на определении маркеров клеточной поверхности. В текущих исследованиях проводится выявление взаимосвязей между этими клетками. К сожалению, адекватная адоптивная модель для определения типа многофункциональных клеток, контролирующих репликацию ВИЧ, пока не создана. Таким образом, необходима разработка количественных методов для выяснения, какие типы иммунных реакций связаны с контролем репликации ВИЧ. Эта задача усложняется влиянием реакций неспецифического иммунитета на количественные и качественные характеристики адоптивного иммунитета.12 Из этого следует, что даже если характер иммунного ответа четко определен, для того чтобы установить его происхождение, потребуется значительное количество наблюдений. Большую помощь в получении ответов на эти вопросы, а также в дальнейшей разработке и испытаниях вакцин могут оказать исследования на обезьянах. Однако в настоящее время, по-видимому, только исследования у человека позволят установить, является ли какой-то определенный тип иммунного ответа наиболее эффективным для изменения репликации ВИЧ-1.
Повышенная восприимчивость к ВИЧ у лиц, имевших до начала испытания Step иммунитет к Ad5
Самым неожиданным результатом исследования Step оказался вдвое больший риск заражения ВИЧ у участников, имевших антитела к Ad5. Подобных данных не отмечалось ни в одном из исследований аденовирусных векторных вакцин у обезьян. Пока остается неизвестным, связан ли этот риск с биологическими особенностями или же обусловлен влиянием внешних факторов, таких как половое поведение или преобладание на определенной географической территории вирусных штаммов с необычно высокой вирулентностью. В ходе исследования обнаружены выраженные географические различия в доле лиц, серо-позитивных к Ad5. Так, в Северной Америке Ас15-серонегативные индивидуумы встречались в 2 раза чаще, чем в Южной Америке или на Карибских островах. Однако среди участников, получавших плацебо, частота инфицирования ВИЧ у Ас15-серонегативных лиц была выше, чем у Ad5-серопозитивных, хотя эта разница не была статистически достоверной (см. табл. 1).
В настоящее время вопрос о том, что в основе повышенного риска инфицирования ВИЧ улиц, имеющих антитела к Ad5, лежит некий биологический механизм, остается неясным. Тем не менее, как следует из рис. 1, среди участников, получавших плацебо, статистически достоверной разницы между риском инфицирования ВИЧ у Ad5-cepono3HTHBHbix и Ad5-cepoHeraTHBHbix мужчин выявлено не было при проведении как одно-, так и многофакторного статистического анализа. Также не отмечено увеличения риска ВИЧ-инфицирования у вакцинированных Ad5-cepoHeraTHBHbix мужчин или женщин. Это свидетельствует о том, что испытания аденовирусных векторных вакцин против ВИЧ (также, как и других заболеваний в группах риска по ВИЧ-инфекции) могут быть благополучно продолжены у Ad5-cepoHeraTHBHbix лиц.
Для объяснения повышенной восприимчивости к инфекции после вакцинации у лиц, имеющих антитела к Ad5, по сравнению с Ad5-cepoHeraTHBHbiMH участниками выдвинуто несколько гипотез.
1. Введение вакцины лицам, имеющим антитела к аденовирусному вектору, приводит к активации Т-лимфоцитов, специфичных к аденовирусу (особенно лимфоцитов CD4 и преимущественно в слизистых оболочках). В результате увеличения количества активных клеток-мишеней для ВИЧ повышается восприимчивость к инфекции у лиц с сексуальным поведением, характеризующимся высоким риском заражения ВИЧ.
2. Наличие иммунитета к Ad5 приводит к смещению иммунного ответа в сторону вектора вакцины и снижает неспецифическую иммунную защиту против ВИЧ, что повышает восприимчивость к ВИЧ у наиболее подверженных заражению ввиду особенностей сексуального поведения категорий мужчин.
3. Наличие иммунитета до вакцинации связано с продукцией антител, облегчающих проникновение вируса, что ведет к повышению восприимчивости к инфекции.
Возможны и другие объяснения этого явления, так же, как и сочетание представленных гипотез. Дополнительный интерес представляет тот факт, что заражение ВИЧ в исследовании Step в 100% случаев наступило после введения второй дозы вакцины. Таким образом, у большинства Ad5-cepoHeraTHBHbix участников, вероятно, произошла сероконверсия по отношению к аденовирусу и к моменту заражения ВИЧ-1 уже выработался иммунный ответ, опосредованный специфичными к аденовирусу лимфоцитами CD4 и CD8. Этот факт необходимо принимать во внимание при любом механистическом объяснении различий восприимчивости к ВИЧ у Ad5-cepono3HTHBHbix и Ad5-cepoHeraTHBHbix лиц. Согласно одной из теорий, разница может быть обусловлена импринтингом определенного фенотипа, например более выраженного тропизма Ad5 к слизистым оболочкам при обычном способе заражения аденовирусной инфекцией, чем при внутримышечном введении репликационно некомпетентного вектора Ad5. Независимо от последней теории, одним из уроков, полученных во время исследования Step, является признание необходимости оценки местного (в слизистых оболочках) и тканеспецифического иммунного ответа как к Ad5-BeKTopy, так и к ВИЧ-вакцине в ходе дальнейших испытаний.
Лабораториями, сотрудничавшими в исследованиях Step и Phambili (HVTN и Merck Research Laboratories), внесены некоторые изменения в ход исследований, целью которых было получение ответов на вышеперечисленные вопросы. Изучаются биоптаты слизистых оболочек, взятые у вакцинированных, для выявления различий в количестве и виде Т-клеток, присутствующих в слизистых, у лиц с естественно приобретенным иммунитетом к Ad5 и у лиц с поствакцинальным иммунитетом KAd5. Поскольку большинству участников исследования Step последняя доза вакцины была введена за 6—11 мес. до исследования биоптатов слизистых оболочек, этот подход может оказаться не вполне оптимальным. В идеале, чтобы получить достоверную информацию относительно тканеспецифического Т-клеточного иммунного ответа на введение вакцины с аденовирусным вектором, необходимо провести проспективное исследование. Поскольку определение вероятного механизма заражения требуетсядля дальнейшей разработки вакцин, основанных на аденовирусных векторах, желательно появление иммуногенов для проведения этих исследований. Ответ на эти вопросы имеет фундаментальное значение для области иммунологии, занимающейся Т-клеточными вакцинами. В связи с этим организаторами испытаний — Merck Research Laboratories, NIAID и HVTN — учрежден научный комитет, задачей которого было наблюдение за проведением исследований, направленных на выяснение этих вопросов.
Заключение
Исследование Step стало важным событием в области разработки вакцин, направленных на стимуляцию Т-клеточного ответа. Их результатом стало несколько уникальных научных открытий в сфере ВИЧ-инфекции, доказательство того, что контрольное заражение вирусом HIV 89.6Р генетически восприимчивых к ВИЧ макак-резусов (MAMU-A*01 или В*08) не должно использоваться для определения эффективности вакцины, а также вывод о необходимости тщательной оценки вектор-индуцированного иммунитета в процессе усовершенствования вакцины. И хотя не было создано эффективной вакцины, в настоящее время проводится критический анализ полученных результатов. Эти данные помогут установить наличие корреляционных связей между иммунным ответом хозяина на введение вакцины и подавлением вирусной нагрузки, и именно этими данными будут руководствоваться при определении иммунологических параметров в ходе испытаний будущих вакцин-кандидатов.