Цель. Побочными эффектами терапии нуклеозидными ингибиторами обратной транскрип-тазы (НИОТ) и некоторыми ингибиторами протеазы ВИЧ являются липоатрофия, перераспределение жировой клетчатки с развитием ожирения туловища и инсулинорезистентность.
Эти побочные эффекты недостаточно хорошо исследованы у взрослых больных, которые только начали получать антиретровирусную терапию (APT). Мы исследовали влияние терапии ингибиторами протеазы ВИЧ на состав тела, чувствительность к инсулину и уровень цитокинов жировой ткани.
Дизайн. Настоящее исследование длилось 48 нед., оно было частью рандомизированного, не слепого исследования, сравнивающего три режима APT.
Условия. Больницы и амбулаторные центры, занимающиеся лечением ВИЧ-инфицированных.
Участники. 140 взрослых ВИЧ-инфицированных, ранее не получавших APT.
Лечение. Тенофовир и ламивудин в сочетании с типранавиром/ритонавиром (500 мг/200 мг 2 раза в день [TPV/r200]), либо типранавиром/ритонавиром (500 мг/100 мг 2 раза в день [TPV/ rlOO]), либо лопинавиром/ритонавиром (400 мг/100 мг 2 раза в день [LPV/r]).
Основные показатели. Состав тела (по данным двухфотонной рентгеновской абсорбциоме-трии для оценки подкожной жировой клетчатки на конечностях и по данным компьютерной томографии на уровне IV поясничного позвонка для оценки жировой клетчатки внутренних органов), а также ряд метаболических показателей натощак. Основным показателем было изменение массы подкожной клетчатки на конечностях в трех исследуемых группах.
Результаты. Масса подкожной клетчатки на конечностях увеличилась во всех трех группах: на 1,17 кг в группе LPV/r по сравнению с 0,83 кг в группе TPV/r200 (р = 0,16) и 0,41 кг в группе TPV/rlOO (р = 0,07). Площадь жировой клетчатки внутренних органов уменьшилась во всех группах: —3 см2 в группе LPV/r по сравнению с —9 см2 в группе TPV/r200 (р = 0,04) и —6 см2 в группе TPV/rlOO (р = 0,40). Чувствительность к инсулину не изменилась, что подтверждено пероральным тестом на толерантность к глюкозе. Нарастание уровня лептина коррелировало с увеличением массы подкожной клетчатки конечностей (г = 0,67; р < 0,0001). Несмотря на нарастание массы подкожной клетчатки конечностей, уровень адипонекти-на увеличивался, при этом он был выше в группах TPV/r200 (+6010 нг/мл; р < 0,0001) и ТРУ/гЮО (+4497 нг/мл; р = 0,002), чем в группе LPV/r (+1360 нг/мл).
Сокращения: DEXA — двухфотонная рентгеновская абсорбциометрия; LPV/r — лопинавир/ритонавир; TPV/r — типранавир/ ритонавир; APT — антиретровирусная терапия; КТ — компьютерная томография; АПВП — липопротеиды высокой плотности; НИОТ — нуклеозидные ингибиторы обратной транскриптазы.
Выводы. В отличие от многих других схем APT терапия тенофовиром и ламивудином в сочетании с типранавиром/ритонавиром или лопинавиром/ритонавиром в течение 48 нед. сопровождалась увеличением массы подкожной клетчатки без нарастания жировой клетчатки внутренних органов и развития инсулинорезистентности.
Введение
Липодистрофия при ВИЧ-инфекции проявляется атрофией подкожной жировой клетчатки с относительным нарастанием жировой клетчатки внутренних органов и, как правило, сопровождается дислипидемией, инсулинорезистентностью и, реже, сахарным диабетом типа 2. Впервые липодистрофия была зарегистрирована у больных, получавших ингибиторы протеазы. Некоторые из них, включая комбинацию лопинавир/ ритонавир, могут влиять на дифференцировку, функционирование и размер адипоцитов подкожной жировой клетчатки in vitro, но, как правило, в концентрациях, значительно превышающих терапевтические.4 6
В отличие от ингибиторов протеазы НИОТ играют более значимую роль в развитии липоатрофии. Замена НИОТ на лопинавир/ритонавир приводила кувеличе-нию массы подкожной жировой клетчатки.7 Ставудин (НИОТ) чаще вызывал липоатрофию, чем индинавир (ингибитор протеазы).3 Наконец, рандомизированные клинические испытания показали разное влияние трех различных ингибиторов протеазы на атрофию подкожной клетчатки конечностей: по сравнению с эфа-вирензом нелфинавир вызывал более выраженную липоатрофию, атазанавир (без ритонавира) — сходную с эфавирензом степень липоатрофии, и наконец, по данным крупного и длительного испытания, лопинавир/ритонавир вызывал менее выраженную липоатрофию.840
Влияние ингибиторов протеазы было оценено в одном исследовании, где больные либо продолжали терапию этими препаратами, либо переходили на другую терапию.11 Препараты замены — адефовир и гидроксимо-чевина — вызывали выраженную анорексию, поэтому неясно, что приводило к уменьшению жировой клетчатки внутренних органов: отмена ингибиторов протеазы или похудение, связанное с анорексией. Влияние начала APT на жировую клетчатку внутренних органов у больных не изучено.
Как свидетельствуют отдельные клинические случаи, популяционные исследования и короткие клинические испытания на здоровых добровольцах, ингибиторы протеазы, включая ритонавир в низких дозах, могут быстро вызывать инсулинорезистентность и сахарный диабет типа 2. Однако неясно, сохраняются ли эти побочные эффекты более 2—4 нед. — срок исследований у добровольцев.12-13
У ВИЧ-инфицированных с липодистрофией снижен уровень адипонектина.1417 При этом у здоровых добровольцев уже через 4 нед. терапии ингибиторами протеазы содержание адипонектина повышалось.18 Уровень лептина нарастал в течение первых 24 нед. терапии НИОТ, и чем выше он становился, тем выше был риск развития липоатрофии.
Влияние начала APT, в состав которой входили ингибиторы протеазы в комплексе с ритонавиром, но не было НИОТ, на подкожную жировую клетчатку, жировую клетчатку внутренних органов, чувствительность к инсулину и уровень адипокинов ранее не исследовалось. Мы изучили влияние терапии типранавиром/ритонавиром или лопинавиром/ритонавиром в комбинации с тенофовиром и ламивудином на упомянутые выше показатели у взрослых больных, ранее не получавших APT.
Методы
Описание исследования
Исследование 1182.33 — рандомизированное, неслепое испытание трех схем APT (номер в регистре клинических испытаний США NCT00144105). Первая схема включала типранавир/ритонавир 500 и 200 мг соответственно 2 раза вдень (TPV/r200), вторая — типранавир/ритонавир 500 и 100 мг соответственно 2 раза в день (TPV/гЮО) — была предложена из-за возможной лучшей переносимости, чем схема с высокой дозой ритонавира, и третья схема — лопинавир/ритонавир 400 и 100 мг соответственно 2 раза вдень (LPV/rl00). В группе TPV/r200 в течение первых 2 нед. больные получали ритонавир по 100 мг 2 раза в сутки. Лопинавир был выбран в качестве контроля, как наиболее часто используемый ингибитор протеазы у взрослых больных, ранее не получавших APT. Больные во всех трех группах получали базисную терапию НИОТ: тенофовир 300 мг 1 раз вдень и ламивудин 300 мг 1 раз вдень. Эти препараты были выбраны из-за их эффективности, хорошей переносимости, удобства дозировки (1 раз вдень) и низкого риска развития липоатрофии.20-21 Рандомизация проводилась после стратификации больных по уровню лимфоцитов CD4 (больше или меньше 200/мкл).
Исследование 1182.33 проходило в Испании (пять центров), Аргентине и Австралии (по четыре центра в каждой стране), Бразилии, Румынии и России (по два центра в каждой стране) и в Канаде (один центр). Было оценено влияние терапии типранавиром/ритонавиром и лопинавиром/ритонавиром на состав тела и метаболизм. Чтобы уменьшить ошибку, связанную с набором больных, мы разрешили исследовательским центрам включать пациентов до тех пор, пока все группы не были полностью набраны.
Основное исследование (оценка динамики подкожной клетчатки на конечностях) и изучение метаболизма были одобрены местными этическими комитетами и контролирующими органами. Каждый участник исследования подписал письменное информированное согласие.
Отбор участников
Основные критерии включения: инфекция ВИЧ-1, возраст старше 18 лет, предшествующая APT длительностью не более 7 дней, уровень лимфоцитов CD4 менее 500/мкл, концентрация ВИЧ-1 в плазме крови не менее чем 5000 копий/мл и повышение активности печеночных трансаминаз не выше I степени. Критерии исключения: СПИД и связанные с ним заболевания, текущая или планируемая беременность и грудное вскармливание, прием экспериментальных иммуномодуляторов или препаратов, которые могут значительно снижать уровень исследуемых препаратов в плазме крови или низкие шансы выживания в ближайшие 12 мес. Метаболические показатели не влияли на включение в исследование.
Распределение жировой клетчатки
Двух-фотонная рентгеновская абсорбциометрия
Распределение жировой клетчатки в целом и в отдельных частях тела изучалось с помощью двух-фотонной рентгеновской абсорбциометрии (DEXA) перед началом исследования и 48 нед. спустя. Площадь жировой ткани определялась специалистом вручную.17 Каждый участник был обследован на одном и том же аппарате. Сбор и обработка данных, контроль их качества, анализ и хранение осуществлялись центральной лабораторией Bio-Imaging (Лейден, Голландия). Каждое исследование было оценено двумя специалистами. Чтобы обеспечить стабильное качество данных и их анализа в различных центрах, в каждом исследовательском центре был проведен контроль качества аппаратуры. Стандартизация аппаратуры и полученных данных выполнены перед включением центра в исследование и в дальнейшем проводились через регулярные промежутки времени. Для стандартизации использовали муляж Bona Fide Variable Composition Phantom (Bio-Imaging). Этот муляж исследовали в различных конфигурациях, чтобы воспроизвести различную степень выраженности жировой ткани (в процентах), его также использовали для оценки воспроизводимости и точности измерений состава тела с помощью DEXA.
Компьютерная томография
КТ проводили перед началом исследования и 48 нед. спустя. Оценивали площадь жировой ткани внутренних органов и подкожной жировой клетчатки на уровне середины IV поясничного позвонка.17 Оборудование, методика и параметры исследования (поле обзора, матрица, толщина среза и расстояние между срезами) были стандартизованы. Все изображения были оцифрованы и их качество и соответствие протоколу оценены в Bio-Imaging.
Результаты КТ оценены одним рентгенологом, не участвующим в исследовании, которому не была известна информация о больных и лечении. Оценки были зарегистрированы в электронном виде и прочитаны трижды.
Другие измерения состава тела
Перед началом исследования и 48 нед. спустя мы исследовали следующие показатели: окружность талии и бедер;17 частота возникновения и степень выраженности липодистрофии (объективно оценены на основании диагностических критериев липодистрофии и соответствующей шкалы для оценки степени тяжести);22 изменения формы те ла в семи участках по данным специальных опросников (субъективная оценка), оцененные как самими участниками, так и врачами.17
Метаболические параметры
Кровь для оценки параметров метаболизма забирали каждые 12 нед., натощак, после голодания не менее 12 ч, у не-обезвоженных больных, отдыхавших перед забором крови не менее 30 мин. Каждые 12 нед. исследовали уровень глюкозы, липопротеидов высокой плотности (ЛПВП), общего холестерина и триглицеридов. Каждые 24 нед. изучали уровень адипонектина, инсулина и леп-тина. Стандартный 2-часовой пероральный тест на толерантность к глюкозе с 75 г глюкозы проводили перед началом исследования и через 48 нед. Все метаболические параметры оценивали в лабораториях компании Covance Central Laboratory Services (Индианаполис, США; Женева, Швейцария; Сидней, Австралия).
Концентрацию триглицеридов, общего холестерина, ЛПВП и глюкозы исследовали с помощью стандартных ферментных методов (Roche Diagnostics, США). Уровень инсулина определяли с помощью набора Access Ultrasensitive Insulin (Beckman Instruments, США), с нижней границей чувствительности 0,03 мкМЕ/мл. Уровень адипонектина и лептина оценивали с помощью количественного иммуноферментного анализа (R&D Systems, США), с нижней границей чувствительности 3,9 нг/мл (коэффициент вариации менее 15%) для адипонектина и 7,8 пг/мл — для лептина.
Для оценки инсулинорезистентности и секреции инсулина (3-клетками мы рассчитали индексы НОМА-R и НОМА-В соответственно.23 Для их расчета использовались следующие формулы:
HOMA-R = глюкоза натощак (ммоль/л) х инсулин натощак (мЕД/л)/22,5,
НОМА-В =20 х инсулин натощак (мЕД/л)/глюкоза натощак (ммоль/л) — 3,5
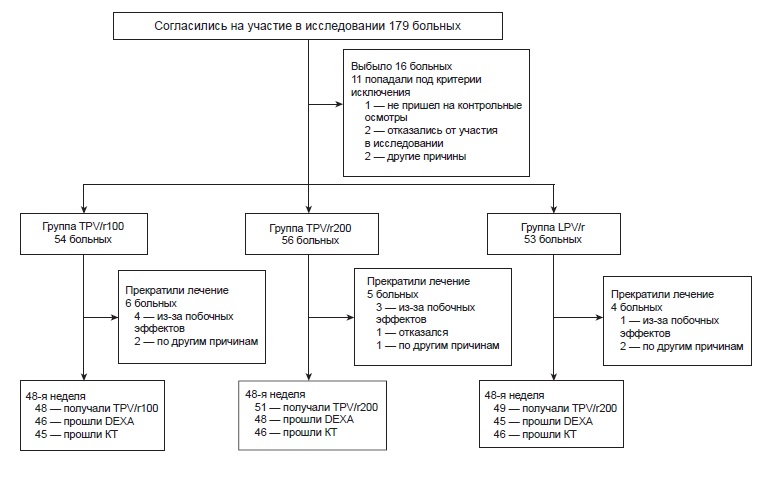
Рис. 1. Схема исследования
Статистические методы
Изначально основное исследование было запланировано на 3 года, а настоящая часть — на 96 нед. Основное исследование было досрочно завершено, поскольку промежуточный анализ данных, полученных через 48 нед. после начала исследования, показал, что схема TPV/rlOO была менее эффективной, чем LPV/r, тогда как схема TPV/r200 имела сходную эффективность, но худшую переносимость.24 Вследствие досрочного завершения исследования лишь немногие больные получили терапию в течение 96 нед., поэтому для анализа использовали только данные, полученные после 48 нед. терапии.
Главным исследуемым параметром была масса подкожной клетчатки конечностей до исследования и через 48 нед. терапии в группе LPV/r по сравнению с обеими группами TPV/r, оцененная с помощью критерия Уил-коксона (сумма рангов). Мы не сравнивали две группы TPV/r между собой, чтобы уменьшить число сравнений. Для оценки чувствительности анализа мы использовали критерий Уилкоксона с поправкой на уровень лимфоцитов CD4 (более или менее 200/мкл). Для того чтобы понять, сравнимы ли три группы до лечения по массе подкожной клетчатки конечностей, мы использовали критерий Краскала—Уоллиса.
Выраженность эффекта от вмешательства рассчитана с помощью программы nQuery Advisor 4.0, исходя из стандартного отклонения, равного 0,8 кг, и различия в 0,7 кг для массы подкожной клетчатки конечностей по данным DEXA, которая, в свою очередь, была использована для расчета размера выборки с применением критерия Уилкоксона, основываясь на допущении, что данные подчинялись нормальному распределению.25 При наличии в группе 30 испытуемых двусторонний критерий Уилкоксона имеет силу 80 % для непрерывных данных с уровнем значимости 0,025, выбранным с учетом множественных групп. Ввиду того, что 40 % участников обычно выбывают из исследования, мы набрали в каждую группу по 50 человек.
Изменение состава тела и параметров метаболизма до начала исследования и спустя 48 нед. оценивали, используя критерий Уилкоксона для суммы рангов.
С помощью метода обратной регрессии мы провели анализ факторов, связанных с изменением массы подкожной клетчатки конечностей, жировой клетчатки внутренних органов иуровня адипонектина. Помимо терапии исследуемым препаратом, которая всегда входила в список факторов, мы оценили возраст, пол, индекс массы тела перед началом терапии, уровень лимфоцитов CD4, концентрацию ВИЧ в плазме крови, уровень инсулина, адипонектина, лептина, общего холестерина, триглицеридов, площадь жировой клетчатки внутренних органов и подкожной клетчатки конечностей. Достоверность изменений подкожной клетчатки конечностей, уровня липидов и углеводного обмена внутри группы до начала исследования и спустя 48 нед. подтверждена с помощью критерия Уилкоксона. Весь анализ проведен на данных, полученных у больных, которые вошли в исследование.
Результаты
Участники
В исследование было приглашено 179 больных, из них 163 вошли в исследование и были распределены на ту или иную схему терапии. У 140 (86%) пациентов имелись результаты DEXA или КТ перед началом исследования и 48 нед. спустя, у 136 (83%) — результаты обоих обследований (рис. 1). Группы были сходны по основным показателям (табл. 1). Число больных с уровнем лимфоцитов CD4 более 200/мкл было выше в группе LPV/r (67%), чем в группе TPV/rlOO (54%) или TPV/r200 (52 %).
Таблица 1. Исходные характеристики исследуемых групп
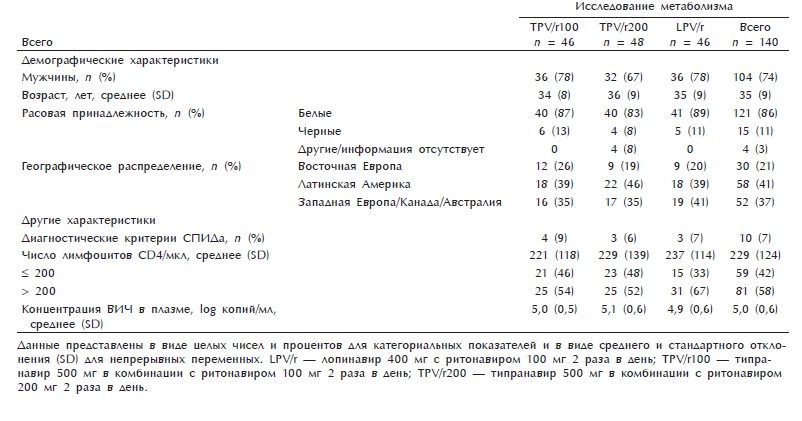
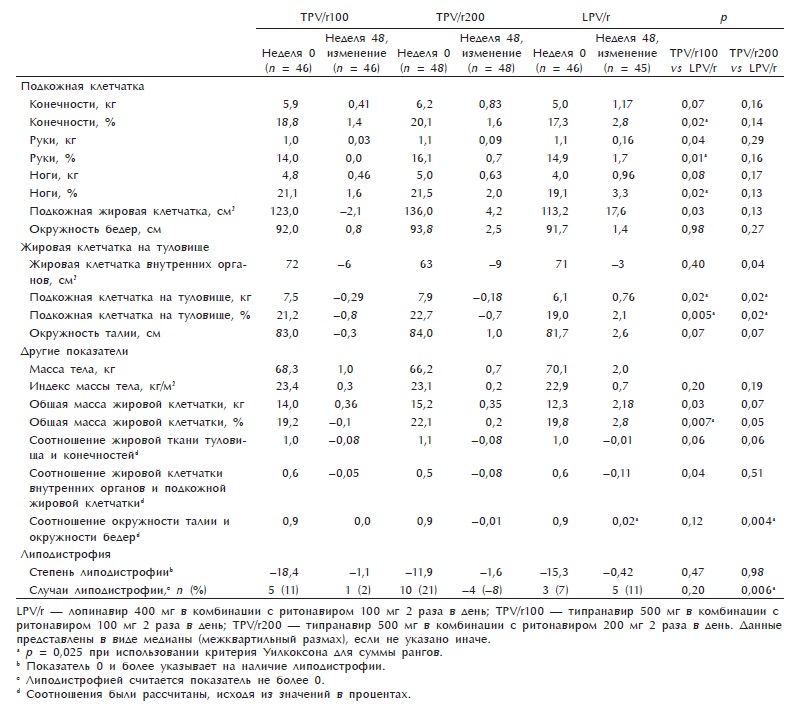
Таблица 2. Состав тела перед началом исследования и спустя 48 нед. терапии
Никто из участников данного исследования не перешел на другой ингибитор протеазы ВИЧ, и ни у кого не было выявлено сахарного диабета в течение 48 нед. исследования. Четверо из 140 испытуемых, по 2 в группе TPV/rlOO и TPV/r200, во время исследования получали гиполипиемическую терапию (гемфиброзил).
Распределение жировой клетчатки
Подкожная жировая клетчатка
Медиана массы подкожной клетчатки до начала исследования была незначительно выше в группах, получавших типранавир,чем в группе, получавшей лопина-вир (критерий Краскала—Уоллиса; р = 0,91). Медиана нарастания подкожной клетчатки на конечностях через 48 нед. терапии была незначительно выше в группе LPV/r (1,17 кг), чем в группе TPV/r200 (0,83 кг) или TPV/rlOO (0,41 кг) (табл. 2). После стратификации больных с учетом исходного уровня лимфоцитов CD4 медиана нарастания подкожной клетчатки была достоверно выше в группе LPV/r, чем в группе TPV/rlOO (р = 0,03) или TPV/r200 (р = 0,05). Во всех группах отмечалось увеличение подкожной клетчатки в течение 48 нед. исследования: TPV/r200 (р = 0,0024), TPV/rlOO (р = 0,012) и LPV/r (р < 0,0001).
В целом в ходе исследования медиана подкожной клетчатки на конечностях и окружность бедер увеличились во всех трех группах, однако в группе LPV/r — более выраженно. Повышение массы жировой клетчатки на туловище (какабсолютное, таки в процентах)достоверно различалось между группами TPV/rlOO и TPV/r200 и группой LPV/r. Также отмечалось достоверное различие в увеличении подкожной жировой клетчатки рук, ног, конечностей, общего процента жировой массы тела, но не окружности бедер между группами TPV/rlOO и LPV/r. Нарастание подкожной клетчатки в группе LPV/r было выше, чем в группах TPV/rlOO и TPV/r200, хотя различия были недостоверными. После стратификации этих параметров в зависимости от исходного уровня лимфоцитов CD4 получены прежние результаты (данные не приводятся).
Два фактора были достоверно связаны с нарастанием подкожной клетчатки конечностей: высокая исходная вирусная нагрузка (увеличение вирусной нагрузки на 1 lg приводило к увеличению массы подкожной клетчатки на конечностях на 0,6 кг; р = 0,02) и низкий уровень инсулина через 2 ч после перорального теста на толерантность к глюкозе в начале исследования (снижение уровня инсулина на 1 мкЕД/мл сопровождалось ростом массы подкожной клетчатки на конечностях на 0,008 кг; р = 0,037).
Жировая клетчатка внутренних органов и подкожная клетчатка на туловище
Жировая клетчатка внутренних органов не нарастала, а, наоборот, несколько снизилась во всех группах, несмотря на увеличение массы подкожной клетчатки на конечностях и массы тела. Наиболее выраженный эффект отмечался в группе TPV/r200 (р = 0,04 по сравнению с группой LPV/r).
Важно, что изменение массы жировой клетчатки внутренних органов положительно коррелирует с изменением массы подкожной клетчатки конечностей (г = 0,25; р = 0,004). Исходными факторами, связанными с наиболее выраженным снижением массы жировой клетки инсулина по НОМА; HOMA-IR — инсулинорезистентность, рассчитанная по НОМА.
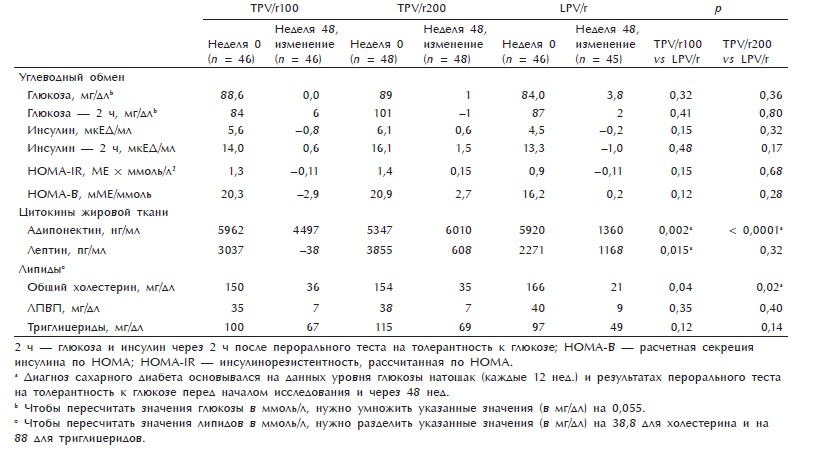
Таблица 3. Метаболические показатели в начале исследования и спустя 48 нед.
Диагноз сахарного диабета основывался на данных уровня глюкозы натощак (каждые 12 нед.) и результатах перорального теста на толерантность к глюкозе перед началом исследования и через 48 нед.
Чтобы пересчитать значения глюкозы в ммоль/л, нужно умножить указанные значения (в мг/дл) на 0,055. с Чтобы пересчитать значения липидов в ммоль/л, нужно разделить указанные значения (в мг/дл) на 38,8 для холестерина и на 88 для триглицеридов.
сопровождалась снижением жировой клетчатки внутренних органов на 0,14 см2; р = 0,014).
Наиболее выраженное, хотя и недостоверно отличающееся от других групп нарастание окружности талии отмечалось в группе LPV/r.
Общий состав тела
Индекс массы тела одинаково вырос во всех группах. Общее распределение жировой ткани изменилось незначительно, небольшие изменения наблюдались в процентном соотношении жировой ткани между туловищем и конечностями, жировой клетчаткой внутренних органов и подкожной жировой клетчаткой, а также соотношением окружности талии и бедер. Тем не менее в группе LPV/r отмечалось значительное увеличение соотношения окружности талии и бедер по сравнению с группой TPV/r200. Кроме того, нарастание общего количества жировой клетчатки и процента жировой клетчатки было выше в группе LPV/r, чем в группах TPV/гЮО и TPV/r200.
Оценка выраженности липодистрофии (исходя из диагностических критериев) выявила относительно небольшие изменения во всех трех группах. Распространенность липодистрофии увеличилась на 11 % в группе LPV/r по сравнению с8% в группе TPV/r200 (р = 0,006) и 2 % в группе TPV/гЮО (р = 0,20).
Субъективные изменения тела
За 48 нед. исследования врачи и участники исследования во всех группах отметили лишь небольшие изменения (набор или потерю) подкожной клетчатки, наиболее выраженные на конечностях (данные не приводятся).
Перед началом исследования почти 90% врачей оценили окружность талии у участников исследования как нормальную, тогда как среди самих участников так считали лишь 74 — 87%. В конце исследования врачи оценили окружность талии как нормальную у 80% пациентов в группе TPV/гЮО, 65% — в группе TPV/r200 и 60% — в группе LPV/r, тогда как сами участники оценили ее как нормальную в 74, 65 и 52% случаев соответственно.
Чувствительность к инсулину
Изменения уровня глюкозы и инсулина в плазме крови натощак, индексов чувствительности к инсулину (НО-MA-IS) и инсулинорезистентности (HOMA-IR), уровня глюкозы и инсулина в плазме крови через 2 ч после теста на толерантность к глюкозе спустя 48 нед. после начала исследования были умеренными и не различались между группами (табл. 3). Во всех трех группах изменения показателей на протяжении исследования были незначительными, за исключением достоверного снижения уровня инсулина натощак в группе TPV/гЮО (р = 0,012) и нарастания уровня глюкозы натощак в группе LPV/r (р = 0,003) (при этом в данной группе несколько снизился уровень инсулина натощак и индекс инсулинорезистентности).
Цитокины жировой ткани
Уровень адипонектина в плазме значительно вырос во всех трех группах (р < 0,0001), но в группах TPV/гЮО и TPV/r200 он был выше, чем в группе LPV/r (см. табл. 3). Тем не менее медиана значений во всех трех группах осталась в пределах нормальных значений.
Среди факторов, влияющих на изменение уровня адипонектина, были пол, уровень триглицеридов перед началом исследования и терапия TPV/r. По сравнению с группой LPV/r в группах TPV/r100 и TPV/r200 отмечалось более выраженное нарастание уровня адипонектина (р = 0,015 и р < 0,0001 соответственно). Уровень адипонектина у женщин был на 4030 нг/мл выше, чем у мужчин (р = 0,004). Увеличение уровня триглицеридов до начала исследования на каждые 10 мг/дл сопровождалось снижением уровня адипонектина на 155 нг/ мл (р = 0,005).
Концентрация лептина увеличилась как в группе LPV/r, так и TPV/r200, однако нарастание лептина в группе LPV/r было значительно выше по сравнению с его снижением в группе TPV/гЮО (р = 0,015). Отмечалась выраженная корреляция между изменением уровня лептина и массой жировой клетчатки конечностей (г = 0,67; р = 0,0001). Нарастание уровня лептина в ходе исследования было значимым только в группе LPV/r (р = 0,001).
Липиды
Уровень общего холестерина и триглицеридов вырос во всех группах, хотя в группах TPV/гЮО и TPV/r200 этот эффект был более выраженным. Нарастание уровня ЛПВП было сопоставимо во всех группах. Соотношение общего холестерина и ЛПВП увеличилось в группах TPV/гЮО и TPV/r200 (+0,3), несколько снизилось в группе LPV/r (—0,1). Изменения всех трех показателей в ходе исследования были значительными во всех группах^ < 0,0001).
Обсуждение
За 48 нед. терапии тенофовиром и ламивудином в сочетании с типранавиром/ритонавиром или лопинавиром/ ритонавиром у больных увеличилась масса подкожной клетчатки на конечностях, при этом масса жировой клетчатки внутренних органов не изменилась, у больных не развились инсулинорезистентность и сахарный диабет типа 2. Отмечалась положительная корреляция между изменениями подкожной клетчатки на конечностях и жировой клетчатки внутренних органов, что ожидаемо для истощенных больных, прибавляющих в массе тела.
Медиана нарастания подкожной клетчатки на конечностях была несколько выше в группах TPV/r100 и TPV/r200, чем в группе LPV/r. Это различие более выражено, если стратифицировать больных по уровню лимфоцитов CD4, поскольку в группе LPV/r уровень лимфоцитов CD4 перед началом исследования был выше. Хотя исходная масса подкожной клетчатки конечностей была меньше в группе LPV/r, спустя 48 нед. терапии различий между тремя группами не было. Таким образом, возможно, что более выраженное увеличение массы подкожной клетчатки спустя 48 нед. в группе LPV/r связано со значительным истощением, вызванным ВИЧ-инфекцией. Результаты нашего исследования по изменению массы подкожной клетчатки конечностей сходны с недавними неопубликованными данными о влиянии начала APT, в состав которой входят ингибиторы протеазы ВИЧ, усиленные ритонавиром, но не входят НИОТ.26 27 Тем не менее к нашим данным следует относиться осторожно, поскольку исследование продолжалось лишь 48 нед. Возможно, масса подкожной клетчатки конечностей будет снижаться после более длительной терапии, хотя исследование терапии лопинавиром/ритонавиром без НИОТ на протяжении 24 мес. не выявило уменьшения массы подкожной клетчатки конечностей.28
Одна из возможных причин увеличения массы подкожной клетчатки — использование ритонавира в низких дозах. Сравнение терапии атазановиром/ри-тонавиром и атазановиром на протяжении 96 нед. показало, что в группе, получавшей атазановир/рито-навир, липоатрофия встречалась реже.29 Кроме того, in vitro ритонавир может стимулировать рост жировой ткани.
То, что масса жировой клетчатки внутренних органов не наросла, стало для нас неожиданностью, поскольку считается, что терапия ингибиторами протеазы ВИЧ приводит к накоплению жировой клетчатки внутренних органов. К этим данным нужно относиться с осторожностью, поскольку мы оценивали жировую клетчатку внутренних органов лишь в начале и в конце исследования. Тем не менее, несмотря на то что мы обнаружили снижение жировой клетчатки внутренних органов, в предыдущих проспективных исследованиях было показано, что у больных, получавших APT, которая включала НИОТ, уже через 24 нед. отмечалось нарастание жировой клетчатки внутренних органов, которое сохранялось до 3 лет.
Ни в одной из групп в ходе исследования не развилась инсулинорезистентность, что подтверждалось пероральным тестом на толерантность к глюкозе. Это не исключает того, что ингибиторы протеазы ВИЧ могут вызывать преходящую или постоянную инсулинорезистентность у небольшого числа больных, но в то же время указывает, что побочные эффекты, характерные для некоторых ингибиторов протеазы ВИЧ, у большинства больных носят временный характер. Возможно, отсутствие инсулинорезистентности связано с отсутствием липоатрофии, поскольку известно, что именно липоатрофия, как врожденная, так и вызванная ВИЧ-инфекцией, вызывает инсулинорезистентность. Другая возможная причина — отсутствие терапии НИОТ, которые могут вызывать инсулинорезистентность еще до того, как возникнут какие-либо изменения жировой клетчатки.27,31
Отсутствие снижения подкожной клетчатки на конечностях, нарастания жировой клетчатки внутренних органов или инсулинорезистентности указывает на то, что у больных, которые начинают получать APT типрана-виром/ритонавиром или лопинавиром/ритонавиром и у которых не развивается липодистрофия, инсулинорезистентность маловероятна. Эта теория требует дальнейшего подтверждения.
Уровень адипонектина в плазме крови вырос во всех группах, особенно у женщин и у больных, получавших типранавир/ритонавир. Эти данные несколько неожиданны, поскольку уровень адипонектина, как правило, снижается при увеличении массы тела. Однако в недавно проведенном исследовании было показано, что у ВИЧ-инфицированных уровень адипонектина ниже, чем у здоровых лиц, и что он продолжал снижаться на фоне APT ингибиторами протеазы ВИЧ.16,33,34 Рост уровня адипонектина, который мы обнаружили, мог быть связан с подавлением ВИЧ-инфекции, однако это маловероятно, поскольку все три схемы APT были достаточно сходны. Другое объяснение в том, что нарастание адипонектина было компенсаторным в ответ на инсулинорезистентность, вызванную APT. В этом случае увеличение содержания адипонектина оказалось эффективным, поскольку чувствительность к инсулину существенно не изменилась. У здоровых добровольцев прием лопинавира/ритонавира или индавира в течение 4 нед. приводил к нарастанию уровня адипонектина и липидов в плазме крови, однако инсулинорезистентность развивалась только при приеме индавира.18 Рост уровня адипонектина может быть компенсаторной реакцией на дислипидемию, вызванную скорее APT, нежели инсулинорезистентностью. Это может объяснить выраженную связь между уровнем триглицеридов до начала исследования и изменением уровня адипонектина в конце исследования. В пользу этой гипотезы говорит исследование, в котором показано, что введение адипонектина мышам, получавшим ритонавир, приводило к снижению уровня липидов.35 Наконец, важно отметить, чтоуровень адипонектина оставался в пределах нормы. Какое клиническое значение имеют эти изменения — неясно.
Нарастание уровня общего холестерина и триглицеридов было выше в группе TPV/r200, чем в группе LPV/r, однако соотношение общего холестерина и ЛПВП — маркера сердечно-сосудистых заболеваний36 — между группами не отличалось.
Хотя изменения степени тяжести липодистрофии были незначительными во всех трех группах, распространенность липодистрофии была выше в группе LPV/r по сравнению с группами TPV/rlOO и TPV/r200.
Это исследование не лишено недостатков. В исследование вошли взрослые больные, преимущественно белой расы. Мы анализировали состав тела только в начале и конце исследования, поэтому возможно, что у больных имелось нарастание подкожной клетчатки с ее последующим снижением (что отмечалось при терапии НИОТ), хотя терапия препаратами, вызывающими липоатрофию (например, ставудин и зидовудин), в течение 1 года, как правило, снижала массу подкожной клетчатки конечностей до уровня ниже исходного, тогда как в настоящем исследовании масса подкожной клетчатки конечностей была значительно выше. Наконец, мы не включали в исследование больных с нарушениями углеводного обмена, у которых могла быть снижена способность компенсировать нарушения метаболизма, вызванные APT.
Наше исследование указывает на то, что терапия тено-фовиром и ламивудином в сочетании с типранавиром/ ритонавиром или лопинавиром/ритонавиром не сопровождается значительным риском развития сахарного диабета типа 2 и не приводит к накоплению жировой клетчатки внутренних органов — тяжелых осложнений, вызывающих сердечно-сосудистые заболевания. Кроме того, отсутствие риска липоатрофии может повысить приверженность лечению у больных, которые, боясь стать физически непривлекательными, не соблюдают режим APT.