Причинами выбора нативного Tat-протеина ВИЧ-1 для создания вакцины были его ключевая роль в жизненном цикле вируса, установленная взаимосвязь между наличием Tat-специфического иммунного ответа с бессимптомным течением и меньшей степенью прогрессирования болезни, а также постоянство его аминокислотных последовательностей у разных штаммов ВИЧ и стимулирующее воздействие на дендритные клетки.
Разработке этой вакцины способствовали данные о безопасности и эффективности ее применения у обезьян.
Первая фаза профилактических и терапевтических исследований проводилась одновременно в четырех больницах Италии (больница ‘L. Spallanzani’, больница Сан-Галликано, Римский университет ‘La Sapienza’, больница Сан-Рафаэль) при поддержке Istituto Superi-ore di Sanita (ISS). Унификация данных была достигнута благодаря стандартизации процедур и централизованному лабораторному тестированию.
В рандомизированном двойном слепом плацебо-контролируемом терапевтическом исследовании I фазы приняло участие 27 ВИЧ-инфицированных пациентов, у которых не развивались клинические симптомы (число лимфоцитов CD4 > 400/мкл, минимальный уровень лимфоцитов CD4 > 250/мкл, вирусная нагрузка не более 50 ООО копий/мл), относящиеся к клинической категории А по классификации Центра санитарно-эпидемиологического надзора. Ни один из добровольцев не получал антиретровирусной терапии. Рекомбинантный, биологически активный Tat-протеин1 вводился каждые 4 нед., всего 5 раз, двумя способами: либо подкожно с квасцами в качестве адъюванта (группа А, всего 15 участников), либо внутрикожно без добавок (группа В, 12 участников). В обеих группах были испытуемые, получавшие разные дозы препарата (7,5 мкг — 8 пациентов, 15 мкг — 5, 30 мкг — 7, плацебо — 7). Первичная цель исследования — оценить безопасность вакцины, вторичная — оценить эффективность формирования иммунного ответа. Испытание было зарегистрировано в реестре ClinicalTrials.gov (№ NCT00505401).
Согласно данным, полученным во время терапии (24 нед.) и в период последующего наблюдения (48 нед.), Tat-вакцина безопасна, не вызывает местных и генерализованных побочных эффектов, формирует иммунный ответ при всех апробированных дозах и путях введения. Каких-либо клинических изменений или изменений лабораторных показателей обнаружено не было. Как местные, так и общие побочные эффекты, согласно кодификатору MedDRA,2 были временными, не выше III степени тяжести, и их выраженность не была связана с количеством введенной вакцины. Отчет о безопасности был отправлен в органы государственного регулирования.
Сокращения: ИЛ-4 — интерлейкин-4; у-ИФН — гамма-интерферон.
Вакцинация способствовала увеличению Tat-специфического ответа Т-хелперов типа 1; в группе принимавших плацебо этот эффект не наблюдался. Следует отметить, что вакцинация вызывала ответ Т-хелперов типа 2 у всех участников, отмечался также большой спектр функциональных антител к белку Tat, что редко бывает при естественном течении инфекции.1,3'6 Как при подкожном, так и внутрикожном введении вакцины частота ответа антител IgM к Tat увеличивалась с 17 до 83%, в то время как среди пациентов, получавших плацебо, у одного (группа А) ответ IgM наблюдался еще в самом начале исследования, а у другого (группа В) — однократно на 12-й неделе испытания. Частота ответа анти-Tat IgG и IgA после введения вакцины увеличилась с 11 до 100 и с 0 до 61 % соответственно. В группе плацебо на момент начала исследования анти-Tat IgG или IgA имел 1 пациент из 7 (14%), каких-либо изменений за время испытания не произошло. Увеличение частоты сероконверсии у получавших вакцину по сравнению с плацебо было статистически значимо по анти-Tat IgG и IgM (р = 0,0169 для IgM и р < 0,0001 для IgG соответственно; точный тест Фишера), в то время как по IgA статистическая значимость сероконверсии была спорной (р = 0,0730). Пиковые титры антител наблюдались после четвертой иммунизации. Среднегеометрические значения титров IgM, IgG и IgA равнялись соответственно 34, 1481,31 (до испытания — 9, 15, 5) в группе А и 22, 686, 23 (до испытания — 5, 13, 5) в группе В. Вакцинация Tat увеличивала титры антител у всех участников по сравнению со значениями в начале испытания (IgM — двукратное увеличение, р = 0,0958; IgG — 32-кратное увеличение, р = 0,015; IgA — 4-кратное увеличение, р = 0,0845; /-тест для парных данных), а также расширяла разнообразие В-клеток посредством образования новых ответов на эпитопы, представляющие функциональные Tat-домены. Наоборот, в группе плацебо не отмечено увеличения выраженности гуморального ответа на Tat (среднегеометрические значения для IgM, IgG, IgA соответственно 6, 14, 6 на момент начала исследования и 5, 14, 6 спустя 48 нед.). Иммуноглобулины всех классов, появившиеся после вакцинации, присутствовали и спустя 48 нед. (группа А — 13, 252, 12 и группа В — 11, 114, 12 для IgM, IgG и IgA соответственно). Необходимо отметить, что при внутрикожном введении наблюдались наибольшие значения титров анти-Tat IgM и наиболее стойкий иммунный ответ.
Как указывалось ранее, при естественном течении инфекции, кумулятивный клеточный ответ (в основном, ответ гамма-интерферона [у-ИФН] и, в меньшей степени, лимфопролиферативный ответ) у добровольцев наблюдался чаще (84 %, включая как группу вакцинирования, так и группу плацебо), чем кумулятивный гуморальный ответ (IgM, IgG, IgA) (32% в обеих группах). После иммунизации кумулятивный клеточный ответ на Tat, включая у-ИФН, интерлейкин-4 (ИЛ-4, определялся методом Elispot) и лимфопролифера-цию (определялась по инкорпорации [3Н]-тимидина), увеличивался с 83 до 100% у пациентов, получивших вакцину, а в группе плацебо отмечалось его снижение с 86 до 57 %. Частота лимфопролиферативного ответа на Tat увеличилась с 61 до 89% у получивших вакцину и уменьшилась с 29 до 14% в группе плацебо. Частота ответа у-ИФН повысилась с 55 до 83% в группе вакцинированных и снизилась с 71 до 57 % в группе плацебо.
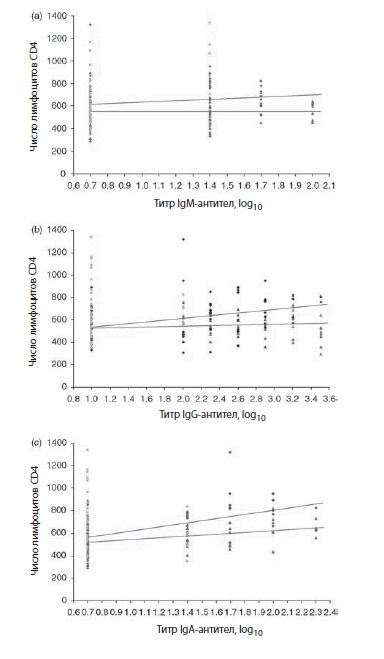
Рис. 1. Взаимосвязь между уровнями лимфоцитов CD4 и титрами IgM-, IgG- и IgA-антител к Tat. Взаимосвязь между уровнями лимфоцитов CD4 и титрами IgM-, IgG- и IgA-антител к Tat (а, b и с соответственно) определялась с помощью модели регрессии для коррелирующих данных. В анализ были включены данные, полученные на 4, 8, 12, 16, 24, 36, и 48-й неделях испытания. Группа А, п/к (треугольники); группа В, в/к (ромбы); плацебо (квадраты). Число лимфоцитов CD4 vs log10 титра IgM-антител: р = 3 (95% ДИ -69, 74) для группы А, р = 57 (95% ДИ -32, 146) для группы В. Число лимфоцитов CD4 vs log10 титра IgG-антител: р = 14 (95% ДИ -40, 69) для группы А, р = 72 (95% ДИ 13, 132) для группы В. Число лимфоцитов CD4 vs logl0 титра IgA-антител: р = 91 (95% ДИ 32, 150) для группы А, р = 193 (95% ДИ 56, 331) для группы В. АИ —доверительный интервал
Примечательно, что частота ответа ИЛ-4 увеличилась в группе вакцинированных с 17 до 50%, а единственный пациент, имевший ответ на момент начала исследования, с течением времени его утратил. Частота ответа ИЛ-4 и лимфопролиферации после вакцинации становится существенно выше, чем у плацебо (р = 0,0267 и 0,01 соответственно; точный тест Фишера). Каких-либо дозозависимых различий не найдено. Для у-ИФН среднее пиковое количество клеток, формирующих пятно, равнялось 276 и 471 на 1 млн клетокдо и после вакцинации в группе А и 201 и 383 — в группе В. Для ИЛ-4 оно составило 21 и 155 до и после вакцинации (группа А) и 10 и 169 (группа В) соответственно. Индекс стимуляции лимфопролиферации до и после вакцинации составлял 12,4 и 8,1 (группа А) и 10 и 169 (группа В). В группе плацебо среднее пиковое количество клеток, формирующих пятно, равнялось 92 и 210 до и после испытания для у-ИФН, 40 и 7 — для ИЛ-4; индекс лимфопролиферации увеличился с 4,3 до 7,3. Оба пути введения вакцины вызывали длительный клеточный ответ у-ИФН, сохранявшийся в течение всего периода последующего наблюдения. При внутрикожном введении наблюдались более выраженные лимфопролиферация и ответ ИЛ-4, нежели при подкожном введении с квасцами. Эти эффекты практически отсутствовали в группе плацебо.
Число лимфоцитов CD4 и вирусная нагрузка в периферической крови расценивались как наиболее значимые параметры по безопасности у всех 27 добровольцев. За время лечения (24 нед.) и в последующий период наблюдения (48 нед.) было установлено, что число лимфоцитов сохранялось на одном и том же уровне, а выраженная виремия отсутствовала, что свидетельствовало о хорошем эффекте вакцинации на иммунологические и вирусологические показатели. Статистический анализ данных показал наличие прямой связи между уровнем циркулирующих лимфоцитов CD4 и титрами энти-Tat IgG (группа В,р = 0,0175) и IgA(группа А,р = 0,0026 и группа В, р = 0,0059), в то время как с титром энти-Tat IgM корреляции не выявлено (рис. 1).
Согласно этим данным, достигнута как первичная (подтверждение безопасности), так и вторичная (подтверждение выработки иммунного ответа) цель исследования. На основании этого спонсор приступает к клиническим исследованиям II фазы.